

分析 (1)根据题意,Fe2O3与NH4HSO4反应生成 NH4Fe(SO4)2和氨气与水;物质分类体系中,NH4Fe(SO4)2、NH4Al(SO4)2都属于复盐,都是强电解质;
(2)SiO2不溶于一般酸性溶液,不溶于氨水;
(3)根据KSP[Al(OH)3]=1×10-32;c(Al3+)均小于或等于1×10-5 mol•L-1可认为完全沉淀,此时c(OH-)3=$\frac{1×10{\;}^{-32}}{1×10{\;}^{-5}}$;
(4)滤液C为硫酸铵,实验室进行第④步操作时,为蒸发结晶操作,所需的仪器是酒精灯、石棉网、三脚架、玻璃棒、蒸发皿.
解答 解:(1)根据题意,Fe2O3与NH4HSO4反应生成 NH4Fe(SO4)2和氨气与水:Fe2O3+4NH4HSO4$\frac{\underline{\;400℃\;}}{\;}$2NH4Fe(SO4)2+2NH3↑+3H2O;物质分类体系中,NH4Fe(SO4)2、NH4Al(SO4)2都属于复盐,都是强电解质;
故答案为:Fe2O3+4NH4HSO4$\frac{\underline{\;400℃\;}}{\;}$2NH4Fe(SO4)2+2NH3↑+3H2O; d;
(2)SiO2不溶于一般酸性溶液,不溶于氨水,故答案为:SiO2;
(3)根据KSP[Al(OH)3]=1×10-32;c(Al3+)均小于或等于1×10-5 mol•L-1可认为完全沉淀,此时c(OH-)3=$\frac{1×10{\;}^{-32}}{1×10{\;}^{-5}}$,此时c(OH-)═1×10-9,pH=5,故答案为:5;
(4)滤液C为硫酸铵,实验室进行第④步操作时,为蒸发结晶操作,所需的仪器是酒精灯、石棉网、三脚架、玻璃棒、蒸发皿;
故答案为:玻璃棒;蒸发皿;(NH4)2SO4.
点评 本题考查了物质制备实验分析判断,物质性质的理解应用,离子方程式、化学方程式书写方法等,掌握基础是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②④ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太快而且太深的呼吸可导致碱中毒 | B. | 太快而且太深的呼吸可导致酸中毒 | ||
| C. | 太浅的呼吸可导致碱中毒 | D. | 太浅的呼吸可导致体内pH升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中化合价升高的元素是NH3中的H | |
| B. | 该反应利用了Cl2的强还原性 | |
| C. | NH3在反应中得到电子 | |
| D. | 生成1molN2有6mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜晶体的堆积方式为面心立方最密堆积 | |
| B. | H2O很稳定是因为水中有氢键 | |
| C. | 氯化钠熔化破坏了离子键 | |
| D. | 12g金刚石中含有的碳碳键数目为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
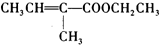 ;以化合物A为原料合成F的工艺流程如图:
;以化合物A为原料合成F的工艺流程如图:

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀.如表中液体X和固体Y的组合,不符合题意的是( )
如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀.如表中液体X和固体Y的组合,不符合题意的是( )| ① | ② | ③ | ④ | |
| X | 水 | 水 | 稀硫酸 | 双氧水 |
| Y | 硝酸铵 | 氢氧化钠 | 氯化钠 | 二氧化锰 |
| A. | ①③ | B. | ②④ | C. | ①② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com