
| c(H+)2 |
| C(酸) |
| c(H+)2 |
| C(酸) |


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:阅读理解
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源:活题巧解巧练·高考化学(第一轮) 题型:013
室温下0.1mol/L NH4CN溶液的pH为9.23,据此,下列说法错误的是
[ ]
A.上述溶液使甲基橙试剂显黄色
B.室温时,NH3是比HCN更弱的电解质
C.上述溶液中CN-的水解程度大于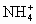 的水解程度
的水解程度
D.室温时0.1mol/L NH4Cl溶液的pH小于0.1mol/L NH4CN溶液
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省暑期复习测试化学试卷(解析版) 题型:选择题
室温下0.1mol·L-1NaOH溶液滴定a mL某浓度的HCl溶液,达到终点时消耗b mLNaOH溶液,此时溶液中氢离子的浓度c(H+)/mol·L-1是( )
A .0.1a/(a+b) B. 0.1b/(a+b) C. 1×107 D. 1×10-7
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省菏泽一中高三(上)期末化学试卷(解析版) 题型:解答题
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com