

分析 (1)试管B中为碳酸钠溶液,可吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度;
(2)乙醇、乙酸易溶于水,导管口在液面下,可发生倒吸;
(3)试管B使用塞子,过量蒸气排不出去,导致安全隐患;
(4)改用图乙装置制取乙酸乙酯,圆底烧瓶上的冷凝管可冷凝回流反应物,提高原料利用率;冷却水下进上出,以此来解答.
解答 解:(1)小试管B中的液体是饱和碳酸钠溶液,可吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度,
故答案为:饱和碳酸钠溶液;
(2)小试管B中的导管不能伸入到液面下,原因是防止倒吸,
故答案为:防止倒吸;
(3)装置中有一个明显错误,改正后才能制取.此错误是试管B口用了橡皮塞,试管B不能密封,
故答案为:试管B口用了橡皮塞;
(4)改用图乙装置制取乙酸乙酯,圆底烧瓶上的冷凝管的作用是冷凝、回流,冷凝管的a口是冷却水的出口,
故答案为:冷凝、回流;出口.
点评 本题考查有机物的制备实验,为高频考点,把握制备实验操作、混合物分离提纯、有机物的性质为解答的关键,侧重分析与实验能力的考查,注意实验安全的分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NO | B. | N2O | C. | NO2 | D. | N2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 操作 | 现象 |
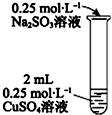 | i有黄色沉淀出现,随着Na2SO3溶液的滴入,沉淀增加,当加到5mL时,溶液的蓝色消失. ii将试管加热,黄色沉淀变为砖红色,有刺激性气味气体产生. iii在加热条件下,继续滴入Na2SO3溶液,砖红色沉淀减少,当加到10mL时,沉淀完全溶解,得无色溶液. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
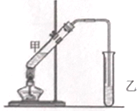 酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如下图所示的装置制取乙酸乙酯.回答下列问题:
酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如下图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
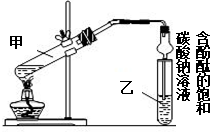 某学习小组在实验室制取乙酸乙酯的主要步骤如下:
某学习小组在实验室制取乙酸乙酯的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
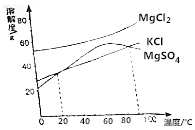 我国食盐有80%来自底下井盐和岩盐,用盐井水晒盐是制取食盐的常用方法.
我国食盐有80%来自底下井盐和岩盐,用盐井水晒盐是制取食盐的常用方法.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com