
【题目】工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Cl-和S![]() 等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的简要工艺流程如图:
等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的简要工艺流程如图:

已知:碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
![]()
(1)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释______。
(2)“趁热过滤”时的温度应控制在______。
(3)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH=+532.36 kJ· mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH=+473.63kJ· mol-1
写出Na2CO3·H2O脱水反应的热化学方程式:_____________。
(4)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用,请你分析实际生产中是否可行:______,其理由是____________________
【答案】Na2CO3在溶液中存在水解平衡C![]() +H2O
+H2O![]() HC
HC![]() +OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强 36 ℃以上 Na2CO3·H2O(s)=Na2CO3(s)+H2O(g) ΔH= +58.73 kJ·mol-1 不可行 若“母液”循环使用,则溶液中c(Cl-)和c(S
+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强 36 ℃以上 Na2CO3·H2O(s)=Na2CO3(s)+H2O(g) ΔH= +58.73 kJ·mol-1 不可行 若“母液”循环使用,则溶液中c(Cl-)和c(S![]() )增大,最后所得产物Na2CO3中混有杂质
)增大,最后所得产物Na2CO3中混有杂质
【解析】
根据题中信息可知,工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Cl-和S![]() 等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠,根据简要工艺流程可知:首先将工业碳酸钠溶解于水,然后加入适量的氢氧化钠溶液将Ca2+、Mg2+、Fe3+充分沉淀,过滤后将滤液蒸发浓缩、结晶,趁热过滤后可得到Na2CO3·H2O,将Na2CO3·H2O加热脱水, 得到试剂级碳酸钠。
等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠,根据简要工艺流程可知:首先将工业碳酸钠溶解于水,然后加入适量的氢氧化钠溶液将Ca2+、Mg2+、Fe3+充分沉淀,过滤后将滤液蒸发浓缩、结晶,趁热过滤后可得到Na2CO3·H2O,将Na2CO3·H2O加热脱水, 得到试剂级碳酸钠。
(1)Na2CO3在水溶液中可以水解使溶液呈碱性,热的Na2CO3溶液有较强的的碱性,有较强的去油污能力。故答案是:Na2CO3在溶液中存在水解平衡C![]() +H2O
+H2O![]() HC
HC![]() +OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强。
+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强。
(2)由题中信息可知,碳酸钠的饱和溶液在36 ℃以上析出的是流程中所得到的Na2CO3·H2O,故“趁热过滤”时的温度应控制在36 ℃以上。
(3)根据已知的热化学方程式①Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH=+532.36 kJ· mol-1和②Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH=+473.63kJ· mol-1,根据盖斯定律可知,①-②可得Na2CO3·H2O(s)=Na2CO3(s)+H2O(g),故其ΔH=+532.36 kJ· mol-1 -473.63kJ· mol-1=+58.73 kJ·mol-1,故Na2CO3·H2O脱水反应的热化学方程式为Na2CO3·H2O(s)=Na2CO3(s)+H2O(g) ΔH= +58.73 kJ·mol-1。
(4)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用,这种想法在实际生产中是不可行的,其理由是:若“母液”循环使用,由于Cl-和S![]() 没有转化为沉淀,则溶液中c(Cl-)和c(S
没有转化为沉淀,则溶液中c(Cl-)和c(S![]() )会不断增大,最后所得产物Na2CO3中混有氯化钠和硫酸钠杂质。
)会不断增大,最后所得产物Na2CO3中混有氯化钠和硫酸钠杂质。


科目:高中化学 来源: 题型:
【题目】下列物质中,能与酸反应,也能与碱反应,还能发生水解反应的是( )
①![]() ;②氨基酸;③
;②氨基酸;③![]() ④淀粉⑤蛋白质⑥纤维素⑦
④淀粉⑤蛋白质⑥纤维素⑦
A.①②⑤B.③⑤⑦C.④⑤⑥D.①③⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土元素包括钪、钇和镧系(含Ce、Eu )共17种元素, 是重要的战略资源,我省稀土资源非常丰富.某彩色电视机显示屏生产过程中产生大量的废荧光粉末含 ( Eu2O3、SiO2、Fe2O3、CeO2、MnO 等物质).某课题组以此粉末为原料, 设计如下工艺流程对资源进行回收,得到较为纯净的CeO2和Eu2O3 (氧化铕).
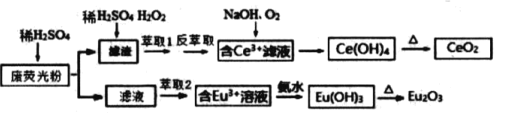
已知:CeO2 不溶于桸硫酸,也不溶于NaOH 溶液,Eu2O3可溶于稀硫酸
(1)往滤渣中加稀硫酸和H2O2进行酸浸,反应的离子方程式____________ 。为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是________________________________。
(2)有机物HR能将Ce3+从水溶液中萃取出来.该过程可表示为:Ce3+(水层)+3HR(有机层)![]() CeR3(有机层)+3H+(水层)。向 CeR3(有机层)中加入稀硫酸进行反萃取能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:________________________。
CeR3(有机层)+3H+(水层)。向 CeR3(有机层)中加入稀硫酸进行反萃取能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:________________________。
(3)流程中由含 Ce3+滤液生成Ce(OH)4的离子方程式____________________。
(4)取上述流程中得到的Ce(OH)4 产品 0.52 g, 加硫酸溶解后,用浓度为 0.1000molL-1FeSO4标准溶液滴定至终点时,铈被还原为Ce3+ , 消耗 24.00 mL 标准溶液。该产品中 Ce(OH)4的质量分数为___________。
(5)已知含 Ce3+溶液也可以先加碱调 pH后再通入氧气氧化可得到Ce(OH)4。298K 时,Ksp[Ce(OH)3]=5×10-20,若溶液中c(Ce3+)=0.05molL-1, 加碱调节pH 到_____时Ce3+开始沉淀(忽略加碱过程中溶液体积变化).
(6)萃取剂对金属离子的萃取率与 pH的关系如图所示.流程中为了用萃取剂除去金属杂质离子,进行萃取2 最适宜的pH 是_______(填选项序号).其原因是 _____。
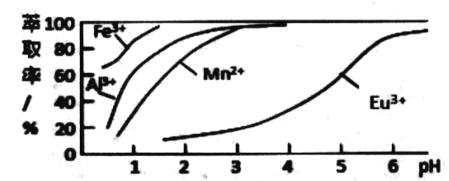
A. 2.0 左右 B . 3.0 左右 C. 5.0 左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物。

文献记载:
I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、﹣3价等氮的化合物。
II.FeSO4+NOFe(NO)SO4(棕色) 。
III.NO2和NO都能被KMnO4氧化吸收。
甲的实验操作和现象记录如下:
实验操作 | 实验现象 |
(1)打开弹簧夹,通入一段时间某气体,关闭弹簧夹。 | |
(2)打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | 无明显现象。 |
(3)加热烧瓶,反应开始后停止加热。 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅。 ②反应停止后,A中有固体剩余。 |
请回答下列问题:
(1)为排除空气对实验的干扰,操作(1)中通入的气体可能是________________。
(2)滴入浓硝酸加热前没有明显现象的原因是__________________________。
(3)试写出加热烧瓶后A中有红棕色气体产生的化学方程式_______________。
(4)甲认为B中溶液变棕色是因为A中有NO生成,你认为甲的观点对吗_________(填正确或错误)?请结合方程式简述原因 ________________________________。
(5)检验是否生成﹣3价氮的化合物,应进行的实验操作是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铬(Cr2O3)的性质独特,在冶金、颜料等领域有着不可替代的地位。一种利用淀粉水热还原铬酸钠制备氧化铬的工艺流程如图:

已知:①向含少量Na2CO3的铬酸钠碱性溶液中通入CO2可制得不同碳化率的铬酸钠碳化母液。
②“还原”反应剧烈放热,可制得Cr(OH)3浆料。
(1)该工艺中“还原”反应最初使用的是蔗糖或甲醛,后来改用价格低廉的淀粉。请写出甲醛(HCHO)与铬酸钠(Na2CrO4)溶液反应的离子方程式__。
(2)将混合均匀的料液加入反应釜,密闭搅拌,恒温发生“还原”反应,下列有关说法错误的是__(填标号)。
A.该反应一定无需加热即可进行
B.必要时可使用冷却水进行温度控制
C.铬酸钠可适当过量,使淀粉充分反应
D.应建造废水回收池,回收含铬废水
(3)测得反应完成后在不同恒温温度、不同碳化率下Cr(Ⅵ)还原率如图。实际生产过程中Cr(Ⅵ)还原率可高达99.5%以上,“还原”阶段采用的最佳反应条件为_、__。

(4)滤液中所含溶质为__。该水热法制备氧化铬工艺的优点有__、__(写出两条即可)。
(5)由水热法制备的氢氧化铬为无定型氢氧化铬[2Cr(OH)3H2O]。将洗涤并干燥后的氢氧化铬滤饼充分煅烧,失去质量与固体残留质量比为_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图点滴板上进行四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是( )
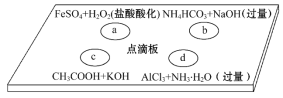
A. a反应:Fe2++2H++H2O2=Fe3++2H2O
B. b反应:HCO3-+OH-=CO32-+H2O
C. c反应:H++OH-=H2O
D. d反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A. 标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA
B. 标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数等于2NA
C. NO2和H2O反应每生成2 mol HNO3时转移的电子数目为2NA
D. 1 mol Fe在氧气中充分燃烧失去3NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,M为金属活动性顺序表中位于氢之前的金属,N为石墨棒,下列关于此装置的叙述中不正确的是

A.N上有气体放出
B.M为负极,N为正极
C.是化学能转变为电能的装置
D.导线中有电流通过,电流方向是由M到N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO、NaNO3、Na2SO3等钠盐在多领域有着较广的应用。
(1)上述三种盐所涉及的五种元素中,半径较小的原子是______________;原子核外最外层p亚层上电子自旋状态只有一种的元素是_____________。
(2)碱性条件下,铝粉可除去工业废水中的NaNO2,处理过程中产生一种能使湿润红色石蕊试纸变蓝的气体。产物中铝元素的存在形式_____________(填化学符号);每摩尔铝粉可处理_____________gNaNO2。
(3)新冠疫情发生后,有人用电解食盐水自制NaClO消毒液,装置如图(电极都是石墨)。电极a应接在直流电源的_____________极;该装置中发生的化学方程式为_____________

(4)Na2SO3溶液中存在水解平衡![]() +H2O
+H2O![]()
![]() +
+![]() 设计简单实验证明该平衡存在__________________。0.1mol/L Na2SO3溶液先升温再降温,过程中(溶液体积变化不计)PH如下。
设计简单实验证明该平衡存在__________________。0.1mol/L Na2SO3溶液先升温再降温,过程中(溶液体积变化不计)PH如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
PH | 9.66 | 9.52 | 9.37 | 9.25 |
升温过程中PH减小的原因是_____________;①与④相比;C(![]() )①____________④(填“>”或“<”).
)①____________④(填“>”或“<”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com