
| A. | 只有①② | B. | 只有①④ | C. | 只有①③④ | D. | ①②③④ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①各气体物质的量浓度不变,说明反应达平衡状态,故正确;
②气体的总物质的量一直不变,故错误;
③混合气体的平均摩尔质量不变,说明气体的质量不变,反应达平衡状态,故正确;
④混合气体的密度不变,说明气体的质量不变,反应达平衡状态,故正确.
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:选择题
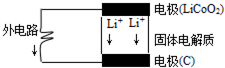 苹果iphone6正在我国热卖,其电池为锂电池.构造如图所示,电池内部“→”表示放电时Li+的迁移方向,电池总反应可表示为:Li1-xCoO2+LixC6$?_{放电}^{充电}$LiCoO2+6C,下列说法错误的是( )
苹果iphone6正在我国热卖,其电池为锂电池.构造如图所示,电池内部“→”表示放电时Li+的迁移方向,电池总反应可表示为:Li1-xCoO2+LixC6$?_{放电}^{充电}$LiCoO2+6C,下列说法错误的是( )| A. | 该电池放电时的负极材料为LiCoO2 | |
| B. | 电池中的固体电解质可以是熔融的氯化钠、氯化铝等 | |
| C. | 充电时的阴极反应:Li1-xCoO2+xLi++xe-═LiCoO2 | |
| D. | 外电路上的“→”表示放电时的电子流向 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| C. | 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该烯烃的一种同分异构体为CH2=CHCH(CH3)2名称为2-甲基-3-丁烯 | |
| B. | 有一种同分异构体的名称为:2,2-二甲基-1-丙烯 | |
| C. | 其属于烯烃的同分异构体有5种 | |
| D. | 该物质的可能结构中最多有两个侧链 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=5的NaHSO3溶液中:c(HSO3-)>c(SO${\;}_{3}^{2-}$)>c(H2SO3) | |
| B. | 使酚酞呈红色的苯酚与苯酚钠混合溶液中:c(Na+)>c(C6H5O-)>c(OH-)>c(H+) | |
| C. | 在0.1 mol•L-1 Na2CO3溶液中:c(HCO${\;}_{3}^{-}$)=c(H2CO3)+c(H+)-c(OH-) | |
| D. | 等物质的量浓度、等体积的NaOH溶液与CH3COOH溶液混合所得溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.0g C2H6中含有共用电子对的数目为0.7×6.02×1023 | |
| B. | 25℃时pH=1的醋酸溶液中含有H+的数目为0.1×6.02×1023 | |
| C. | 已知2CO(g)+O2(g)?2CO2(g)△H=-a kg•mol-1,将2NA个CO与NA个O2混合,充分反应放出a kJ的热量 | |
| D. | 50mL 18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| B. | 只含一种元素的物质,一定不是化合物,但是可能是混合物 | |
| C. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 | |
| D. | 依据CO2、SO3、SiO2为酸性氧化物,可以得出结论:酸性氧化物均为非金属氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com