
在1 L K2SO4和CuSO4的混合溶液中c(SO )=2.0 mol·L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L(标准状况)气体,则原溶液中c(K+)为( )
)=2.0 mol·L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L(标准状况)气体,则原溶液中c(K+)为( )
A.2.0 mol·L-1 B.1.5 mol·L-1
C.1.0 mol·L-1 D.0.50 mol·L-1
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
已知450℃时,反应H2(g)+I2(g)  2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g)  H2(g)+I2(g)的化学平衡常数为
H2(g)+I2(g)的化学平衡常数为
A、50 B、0.02 C、100 D、无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
某天然拒食素具有防御非洲大群蚯蚓的作用,其结构简式如图(未表示出原子或原子团的空间排列)。该拒食素与下列某试剂充分反应,所得有机物分子的官能团数目增加,则该试剂是( )

A.Br2的CCl4溶液 B.Ag(NH3)2OH溶液
C.HBr D.H2
查看答案和解析>>
科目:高中化学 来源: 题型:
在特制的密闭真空容器中加入一定量纯净的氨基甲酸铵固体(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s)2NH3(g)+CO2(g),已知15 ℃时,平衡气体总浓度为2.4×10-3 mol·L-1。下列说法中正确的是( )
A.密闭容器中气体的平均相对分子质量不变则该反应达到平衡状态
B.15 ℃时氨基甲酸铵的分解平衡常数为2.048×10-9
C.恒温下压缩体积,NH3的体积分数减小
D.再加入一定量氨基甲酸铵,可加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,将E(g)和F(g)充入体积不变的2 L密闭容器中,发生下述反应,并于5 min末达到平衡:2E(g)+F(g)2G(g)。有关数据如下:
| E(g) | F(g) | G(g) | |
| 初始浓度/mol·L-1 | 2.0 | 1.0 | 0 |
| 平衡浓度/mol·L-1 | c1 | c2 | 0.4 |
下列判断正确的是( )
A.反应在前5 min内,v(E)=0.04 mol·L-1·min-1
B.其他条件不变,若增大E的浓度,则达平衡时E的转化率会增大
C.其他条件不变,降低温度,平衡时n(E)=3.0 mol,则反应的ΔH>0
D.平衡后移走2.0 mol E和1.0 mol F,在相同条件下再达平衡时,c(G)<0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某100 mL混合酸中,HNO3物质的量浓度为0.4 mol·L-1,H2SO4物质的量浓度为0.2 mol·L-1。向其中加入2.56 g Cu粉,待充分反应后(反应前后溶液体积变化忽略不计),溶液中Cu2+物质的量浓度为( )
A.0.15 mol·L-1 B.0.3 mol·L-1
C.0.225 mol·L-1 D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
在室温条件下,向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,恰好使溶液的pH=7,下列叙述正确的是( )
A.溶液中c(Na+)=2c(SO )
)
B.0<沉淀的物质的量<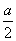 mol
mol
C.沉淀的物质的量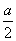 mol
mol
D.原溶液中c(H2SO4)=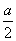 mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
有关“尿不湿”中添加的高吸水性树脂的下列说法中不正确的是
( )。
A.用淀粉、纤维素等天然高分子化合物与丙烯酸、苯乙烯磺酸发生聚合反应制得
B.用聚乙烯醇与丙烯酸反应制得
C.用乙二醇和乙二酸发生缩聚反应制得
D.高吸水性树脂是含有羧基、羟基等强亲水基团并具有一定交联的网状高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
锶(38Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与20Ca和56Ba同属于第ⅡA族。
(1)碱性:Sr(OH)2____Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是______________。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入浓硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3。
已知:ⅰ.相同温度时的溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 |
①Ⅰ中,反应的化学方程式是_________________________________________。
②Ⅱ中,能与盐酸反应溶解的物质有_________________________________。
③Ⅳ的目的是_________________________________________________________。
④下列关于该工艺流程的说法正确的是________(填字母)。
a.该工艺产生的废液含较多的NH 、Na+、Cl-、SO
、Na+、Cl-、SO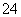
b.Ⅴ中反应时,升高温度一定可以提高SrCO3的生成速率
c.Ⅴ中反应时,加入溶液一定可以提高NH4HCO3的利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com