
| A、pH=2的KHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B、含有AgCl和AgBr固体的悬浊液:c(Ag+)>c(Cl-)=c(Br-) |
| C、NaCl溶液和CH3COONH4溶液均呈中性,所以两溶液中水的电离程度相同 |
| D、PH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):②>③>① |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 实验现象及结论 |
| 将晶体混合,立即快速搅拌 | 有刺激性气味能使湿润的紫色石蕊试纸变蓝的 |
| 用手摸烧杯下部 | 感觉烧杯变凉说明此反应是 |
| 用手拿起烧杯 | 烧杯下面的带有几滴水的玻璃片粘到了烧杯底部 |
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上 | 玻璃片脱离上面烧杯底部 |
| 反应后移走多孔塑料片观察反应物 | 混合物成糊状,证明有 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
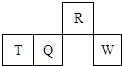 短周期元素R、T、Q、W在元素周期标准的相对位置如图所示,其中T所处的周期序数和族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期标准的相对位置如图所示,其中T所处的周期序数和族序数相等.下列判断不正确的是( )| A、R的简单气态氢化物可以使湿润红色石蕊试纸变蓝 |
| B、W的最高价氧化物的水化物是一种强酸 |
| C、Q的最高价氧化物难溶于水 |
| D、T最高价氧化物的水化物是一种强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 联合国气候变化大会于2009年12月7~18日在哥本哈根召开.中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.
联合国气候变化大会于2009年12月7~18日在哥本哈根召开.中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.
| ||
| ||
| ||
| 太阳光 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 | ||
| A | 取待检液,滴加硝酸酸化的BaCl2溶液 | 产生白色沉淀 | 含有SO42- | ||
| B | 取待检液,滴加氯水后再加几滴KSCN溶液 | 溶液呈红色 | 含有Fe2+ | ||
| C | 用FeCl3溶液腐蚀印刷电路板上的铜,所得溶液中加入铁粉 | 仍然有固体存在 | 反应后溶液中一定有Fe2+ | ||
| D | 取待检液,加入盐酸将产生的气体通入澄清石灰水 | 石灰水变浑浊 | 含有CO32-或SO
|
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,用0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1CH3COOH溶液所得滴定曲线如图,下列说法正确的是( )
常温下,用0.1000mol?L-1NaOH溶液滴定20.00mL0.1000mol?L-1CH3COOH溶液所得滴定曲线如图,下列说法正确的是( )| A、①处水的电离程度大于②处水的电离程度 |
| B、②处加入的NaOH溶液恰好将CH3COOH中和 |
| C、③处所示溶液:c(Na+)<c(CH3COO-) |
| D、滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com