
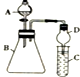
 某同学利用如图装置探究同主族元素非金属性的变化规律.
某同学利用如图装置探究同主族元素非金属性的变化规律.分析 (1)仪器A的名称是分液漏斗;有缓冲作用的仪器能防止倒吸;
(2)要证明酸性强弱,应该采用强酸制取弱酸的方法检验,强酸和弱酸盐反应生成弱酸;硝酸酸性最强,所以A中盛放硝酸,硝酸和碳酸钙制取二氧化碳,二氧化碳和硅酸钠溶液生成硅酸,从而确定酸性强弱;
(3)浓盐酸具有还原性、酸性高锰酸钾溶液具有强氧化性,二者发生氧化还原反应生成氯气,氯气具有强氧化性,能氧化Na2S溶液中的S2-生成S,非金属元素的非金属性越强,其单质的氧化性越强,同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性.
解答 解:(1)仪器A的名称是分液漏斗;有缓冲作用的仪器能防止倒吸,倒置的干燥管有缓冲作用,所以能防止倒吸,故答案为:分液漏斗;倒吸;
(2)要证明酸性强弱,应该采用强酸制取弱酸的方法检验,硝酸酸性最强,所以A中盛放硝酸,硝酸和碳酸钙制取二氧化碳,二氧化碳和硅酸钠溶液生成硅酸,则B中盛放碳酸钙、C中盛放硅酸钠,硅酸难溶于水,所以二氧化碳和硅酸钠反应生成硅酸沉淀,看到的现象是有白色沉淀生成,C中反应质量方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-,
故答案为:稀硝酸;碳酸钙;SiO32-+CO2+H2O=H2SiO3↓+CO32-;
(3)浓盐酸具有还原性、酸性高锰酸钾溶液具有强氧化性,二者发生氧化还原反应生成氯气,氯气具有强氧化性,能氧化Na2S溶液中的S2-生成S,离子方程式为Cl2+S2-=2Cl-+S↓,非金属元素的非金属性越强,其单质的氧化性越强,同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,该反应中Cl元素化合价由0价变为-1价、S元素化合价由-2价变为0价,所以氯气是氧化剂、S是氧化产物,则氧化性:Cl2>S,所以非金属性Cl>S,
故答案为:Cl2+S2-=2Cl-+S↓;强.
点评 本题考查性质实验方案设计,侧重考查学生分析判断及知识运用能力,明确实验原理是解本题关键,知道金属性、非金属性强弱判断方法,注意:(2)装置设计不很合理,生成的二氧化碳中含有硝酸,硝酸和硅酸钠反应也生成白色沉淀,所以在C装置前应该有一个洗气装置,防止吸收干扰实验.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5mol•(L•min)-1 | B. | v(B)=0.4mol•(L•s)-1 | ||
| C. | v(B)=0.3mol•(L•s)-1 | D. | v(C)=0.2mol•(L•s)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的结构式: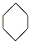 | |
| B. | 乙烯的结构简式C2H4 | |
| C. | 3-甲基-1-丁烯的结构简式:(CH3)2CHCH=CH2 | |
| D. | 羟基(-OH)的电子式: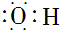 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | ①② | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大力勘探和开采石油 | |
| B. | 多利用天然气少使用石油 | |
| C. | 因为煤的储量比石油丰富,应多使用煤作能源 | |
| D. | 大力发展核能、氢能并充分利用太阳能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
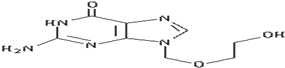 阿昔洛韦[化学名称:9-(2-羟乙氧甲基)鸟嘌呤]是抗非典型肺炎(SARS)的指定药物之一,其结构如图所示,有关阿昔洛韦的结构及性质的叙述中正确的是( )
阿昔洛韦[化学名称:9-(2-羟乙氧甲基)鸟嘌呤]是抗非典型肺炎(SARS)的指定药物之一,其结构如图所示,有关阿昔洛韦的结构及性质的叙述中正确的是( )| A. | ①②③④⑥⑧ | B. | ②④⑤⑥ | C. | ③④⑥⑧ | D. | ④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温下,pH=6的NaHSO3溶液中:c(SO32-)-c(H2SO3)=9.9×10-7mol•L-1 | |
| B. | 0.1mol•L-1的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 0.1mol•L-1pH=4的NaHC2O4溶液:c(H2C2O4)>c(C2O42-) | |
| D. | 向1.0L0.1mol•L-1的醋酸钠溶液中加入1.0L0.1mol•L-1盐酸:c(Na+)>c(CH3COO-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体加入适量的稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液 | 若溶液不变红,则假设一成立,若溶液变红,则假设一不成立 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com