
【题目】I.用相应的方程式解释:
(1)NaHSO3溶液显酸性:___________________
(2)NaHCO3溶液显碱性:____________________
(3)NH4Cl溶液显酸性:______________________
(4)明矾[KAl(SO4)2]净水:___________________
(5)FeCl3溶液蒸干得到Fe2O3固体:____________(第一步反应)
II.向2份0.1mol/LCH3COONa溶液中分别加入少量NH4NO3、Na2CO3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为_______、______(填“减小”、“增大”或“不变”)。
【答案】HSO3-![]() H++SO32- HCO3-+ H2O
H++SO32- HCO3-+ H2O![]() H2CO3+OH- NH4++H2O
H2CO3+OH- NH4++H2O![]() NH3H2O+H+ Al3++3H2O
NH3H2O+H+ Al3++3H2O![]() Al(OH)3+3H+ Fe3++3H2O
Al(OH)3+3H+ Fe3++3H2O![]() Fe(OH)3+3H+ 减小 增大
Fe(OH)3+3H+ 减小 增大
【解析】
I.(1)NaHSO3是强碱弱酸盐,在溶液中HSO3-产生电离平衡和水解平衡,通过比较电离和水解程度大小判断溶液的酸碱性;
(2) NaHCO3是强碱弱酸盐,在溶液中HCO3-产生电离平衡和水解平衡,通过比较电离和水解程度大小判断溶液的酸碱性;
(3)NH4Cl是强酸弱碱盐,在溶液中NH4+水解使溶液酸性;
(4)明矾是强酸弱碱盐,Al3+水解产生Al(OH)3具有吸附性;
(5)FeCl3强酸弱碱盐,Fe3+水解产生Fe(OH)3,蒸干得Fe(OH)3,灼烧Fe(OH)3发生分解反应;
II. CH3COONa溶液水解显碱性, NH4NO3的溶液显酸性;Na2CO3溶液显碱性,根据平衡移动原理分析CH3COO-浓度的变化情况。
I.(1)NaHSO3是强碱弱酸盐,在溶液中HSO3-存在电离平衡:HSO3-![]() H++SO32-,电离产生H+,使溶液显酸性;同时也存在水解平衡:H2O+HSO3-
H++SO32-,电离产生H+,使溶液显酸性;同时也存在水解平衡:H2O+HSO3-![]() OH-+H2SO3,水解产生OH-,使溶液显碱性,由于其电离程度大于水解程度,所以溶液显酸性;
OH-+H2SO3,水解产生OH-,使溶液显碱性,由于其电离程度大于水解程度,所以溶液显酸性;
(2) NaHCO3是强碱弱酸盐,在溶液中HCO3-存在电离平衡:HCO3-![]() H++CO32-,电离产生H+,使溶液显酸性;同时也存在水解平衡:H2O+HCO3-
H++CO32-,电离产生H+,使溶液显酸性;同时也存在水解平衡:H2O+HCO3-![]() OH-+H2CO3,水解产生OH-,使溶液溶液显碱性,由于HCO3-水解程度大于其电离程度,所以溶液显碱性;
OH-+H2CO3,水解产生OH-,使溶液溶液显碱性,由于HCO3-水解程度大于其电离程度,所以溶液显碱性;
(3)NH4Cl是强酸弱碱盐,在溶液NH4+发生水解作用:NH4+ +H2O![]() NH3·H2O+H+,使溶液中c(H+)>c(OH-),溶液显酸性;
NH3·H2O+H+,使溶液中c(H+)>c(OH-),溶液显酸性;
(4)明矾是强酸弱碱盐,在溶液中Al3+发生水解反应:Al3++3H2O![]() Al(OH)3+3H+,水解产生的Al(OH)3胶体表面积大,吸附力强,可吸附水中悬浮的固体,因而具有净水作用;
Al(OH)3+3H+,水解产生的Al(OH)3胶体表面积大,吸附力强,可吸附水中悬浮的固体,因而具有净水作用;
(5)FeCl3是强酸弱碱盐,在溶液中Fe3+发生水解反应:Fe3++3H2O![]() Fe(OH)3+3H+,当溶液蒸干时,由于HCl的挥发,水解平衡正向移动,最终得到的固体是Fe(OH)3,然后灼烧Fe(OH)3发生分解反应产生Fe2O3固体;
Fe(OH)3+3H+,当溶液蒸干时,由于HCl的挥发,水解平衡正向移动,最终得到的固体是Fe(OH)3,然后灼烧Fe(OH)3发生分解反应产生Fe2O3固体;
II. CH3COONa是强碱弱酸盐,在溶液中CH3COO-水解,消耗水电离产生的


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】向某密闭容器中充入0.3molA、0.1molC和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出]。乙图为t2时刻后改变条件时平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3~t4阶段为使用催化剂。下列说法中不正确的是

A.若t1=15s,则用A的浓度变化表示的t0~t1阶段的平均反应速率为0.006mol·L-1·s-1
B.t4~t5阶段改变的条件一定为减小压强
C.该容器的容积为2L,B的起始物质的量为0.02mol
D.该反应的化学方程式为3A![]() B+2C
B+2C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A.“神舟六号”飞船返回舱的表层采用高温时自动烧蚀的耐高温、抗氧化的新型无机非金属材料带走热量从而保证内部温度不致过高。
B.“加碘食盐”“含氟牙膏”“富硒营养品”“高钙牛奶”“加铁酱油”等等,这里的碘、氟、硒指的是分子,钙、铁则分别是钙离子和铁离子。
C.下图是反应物和生成物的能量变化示意图,则其可能发生的反应的热化学方程式可表示为:2A(g)+B(g)=2C(g);△H=QkJ/mol(Q>0)

D.已知4P(红磷,s)=P4(白磷,s);△H>0,则白磷比红磷稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 分子式为C2H6O的有机化合物性质相同
B. 相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能途径a:![]() ,途径b:
,途径b:![]()
C. 在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数
D. 通过化学变化可以直接将水转变为汽油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体置于2L的密闭容器中,混合后发生如下反应:2A(g)+ B(g)=2C(g),若经2s后测得C的浓度为1.2mol/L,下列说法符合题意是( )
A. 用物质A表示的反应速率为1.2 mol/(Ls)
B. 用物质B表示的反应速率为0.3mol/(Ls)
C. 2s时物质A的转化率为40%
D. 2s时物质B的浓度为0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,在铝热反应中常做引发剂;e、f为常见气体单质。下列有关说法正确的是( )

A. 简单离子的半径:Y>Z>X
B. 简单氢化物的沸点:Y>X
C. 最高价氧化物对应水化物的碱性:Z> Y
D. Y、Z的氧化物所含化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知锌与稀盐酸反应放热,某学生为了探究反应过程中的速率变化,用排水集气法收集反应放出的氢气。所用稀盐酸浓度有1.00mol·L-1、2.00mol·L-1两种浓度,每次实验稀盐酸的用量为25.00mL,锌有细颗粒与粗颗粒两种规格,用量为6.50g。实验温度为298K、308K。
(1)完成以下实验设计(填写表格中空白项),并在实验目的一栏中填出对应的实验编号:
编号 | T/K | 锌规格 | 盐酸浓度/mol·L-1 | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和___探究温度对该反应速率的影响; (Ⅲ)实验①和___探究锌规格(粗、细)对该反应速率的影响。 |
② | 298 | 粗颗粒 | 1.00 | |
③ | 308 | 粗颗粒 | 2.00 | |
④ | 298 | 细颗粒 | 2.00 |
(2)实验①记录如下(换算成标况):
时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
氢气体积(mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
①计算在30s~40s范围内盐酸的平均反应速率ν(HCl)=___(忽略溶液体积变化)。
②反应速率最大的时间段(如0s~10s......)为___,可能原因是___。
③反应速率最小的时间段为___,可能原因是___。
(3)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在盐酸溶液中分别加入等体积的下列溶液以减慢反应速率,在不影响产生H2气体总量的情况下,你认为他上述做法中可行的是___(填相应字母);
A.蒸馏水 B.NaNO3溶液 C.NaCl溶液 D.CuSO4溶液 E.Na2CO3
(4)某化学研究小组的同学为比较Fe3+和Cu2+对H2O2分解的催化效果,分别设计了如图甲、乙所示的实验。请回答相关问题:
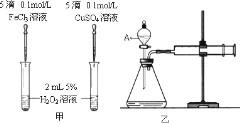
①定性如图甲可通过观察___,定性比较得出结论。甲同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___。受甲同学的启发乙同学提出了另一种方案,你猜想乙同学的方案是___;
②定量如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略,实验中需要测量的数据是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______.
(2)BF3与一定量的水形成(H2O)2BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力有______(填序号).
a.离子键b.共价键c.配位键d.氢键
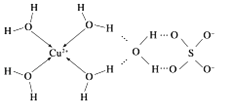
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2﹣,不考虑空间构型,[Cu(OH)4]2﹣的结构可用示意图表示为______ ,科学家推测胆矾结构示意图可简单表示如图:胆矾的化学式用配合物的形式表示为_____________________.
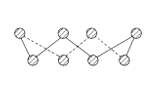
(4)第一电离能介于B、N之间的第二周期元素有______种.S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定体积的密闭容器中,充入2 mol CO2和1 mol H2发生如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_________________。
(2)若反应在830 ℃下达到平衡,则CO2气体的转化率为________。
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则容器内气体温度________(填“升高”、“降低”或“不能确定”)。
(4)能判断该反应是否达到化学平衡状态的依据是____________。
A 容器内压强不变 B 混合气体中c(CO)不变
C v正(H2)=v逆(H2O) D c(CO2)=c(CO)
E c(CO2 )·c(H2)=c(CO)·c(H2O)
(5)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。
已知:CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ·mol-1
△H2=_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com