
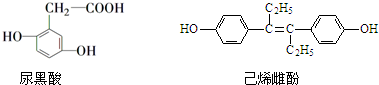
| A. | 尿黑酸分子中所有碳原子一定都在同一平面内 | |
| B. | 己烯雌酚可发生加成、取代、氧化、加聚、酯化反应 | |
| C. | 尿黑酸和己烯雌酚都属于芳香族化合物 | |
| D. | 各1mol的尿黑酸和己烯雌酚分别最多能消耗3mol 和6mol Br2 |
分析 A、羧基上的碳与苯环上的碳可能在同一平面上;
B、己烯雌酚分子中含有双键和苯环可发生加成、氧化、加聚;含酚羟基发生取代和酯化反应;
C、含苯环的化合物是芳香族化合物;
D、1mol的尿黑酸和3molBr2发生取代反应,1mol的己烯雌酚和1mol Br2加成4molBr2发生取代反应.
解答 解:A、羧基上的碳与苯环上的碳可能在同一平面上,所以不一定在同一平面上,故A错误;
B、己烯雌酚分子中含有双键和苯环可发生加成、氧化、加聚;含酚羟基发生取代和酯化反应,所以己烯雌酚可发生加成、取代、氧化、加聚、酯化反应,故B正确;
C、两种有机物中都是含苯环的化合物是芳香族化合物,故C正确;
D、1mol的尿黑酸和3molBr2发生取代反应,1mol的己烯雌酚和1mol Br2加成4molBr2发生取代反应,所以分别最多能消耗3mol 和5mol Br2,故Q错误;
故选BC.
点评 本题考查有机物的结构决定性质,熟记官能团所具有的性质是解题的关键所在,比较容易.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 等二次污染物.
等二次污染物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
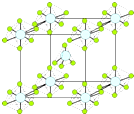 磷元素在生产和生活中有广泛的应用.
磷元素在生产和生活中有广泛的应用.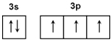 .
.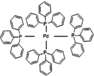 ):P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为sp3;判断该物质在水中溶解度并加以解释不易溶于水.水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶.该物质可用于如图所示物质A(
):P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为sp3;判断该物质在水中溶解度并加以解释不易溶于水.水为极性分子,四(三苯基膦)钯分子为非极性分子,分子极性不相似,故不相溶.该物质可用于如图所示物质A(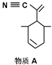 )的合成:物质A中碳原子杂化轨道类型为sp、sp2、sp3;一个A分子中手性碳原子数目为3.
)的合成:物质A中碳原子杂化轨道类型为sp、sp2、sp3;一个A分子中手性碳原子数目为3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B的最高价氧化物对应的水化物的酸性比E强 | |
| B. | 某物质焰色反应呈黄色,该物质一定是含C的盐 | |
| C. | 向D单质与沸水反应后的溶液中滴加酚酞,溶液变红 | |
| D. | B的氢化物的沸点一定高于A的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
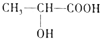 )都是生活中常见的有机物,请按要求完成下列问题;
)都是生活中常见的有机物,请按要求完成下列问题;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com