
| A. | TiO2是氧化剂 | |
| B. | 四氯化钛是还原产物 | |
| C. | Cl2发生氧化反应 | |
| D. | 氧化剂与还原剂的物质的量之比为1:2 |
分析 TiO2+2C+2Cl2→TiCl4+2CO中,C元素的化合价升高,则C为还原剂,Cl元素的化合价降低,则Cl2为氧化剂,以此来解答.
解答 解:A.Ti、O元素的化合价不变,则TiO2不是氧化剂,故A错误;
B.TiO2+2C+2Cl2→TiCl4+2CO中,Cl元素的化合价降低,则Cl2为氧化剂,生成四氯化钛是还原产物,故B正确;
C.Cl元素的化合价降低,则Cl2为氧化剂,发生还原反应,故C错误;
D.氯气为氧化剂,C为还原剂,由反应可知,氧化剂与还原剂的物质的量之比为1:1,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | H2SO4的摩尔质量与NA个硫酸分子的质量在数值上相等 | |
| B. | NA个氧气分子和NA个氮气分子的质量比为8:7 | |
| C. | 28 g氮气所含原子数目为NA | |
| D. | 在标准状况下,0.5 NA个氯气分子所占的体积为11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某固体中加入稀盐酸,产生了无色气体,证明该固体一定是CaCO3 | |
| B. | 某溶液中滴加BaCl2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含SO42- | |
| C. | 某无色溶液滴入无色酚酞试液显红色,该溶液一定显碱性 | |
| D. | 验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加硝酸银溶液,有白色沉淀出现,证明含Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
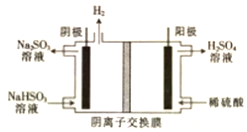 电解原理在工业生产中应用广泛.
电解原理在工业生产中应用广泛.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中,有化学键的断裂与形成 | |
| B. | MgCl2晶体中存在离子键与共价键 | |
| C. | NH3和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | CO2和SiO2晶体都是由分子构成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑ | B. | CO+H2O$\stackrel{高温}{?}$CO2+H2 | ||
| C. | CO2+2NaOH═Na2CO3+H2O | D. | CO+2H2$\stackrel{一定条件}{→}$CH3OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
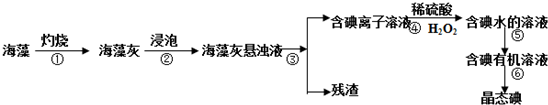
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电解质溶液的电导率越大,导电能力越强.用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol/L的NaOH溶液滴定10.00mL浓度均为0.100mol/L的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法不正确的是( )| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | A、C两点对应溶液均呈中性 | |
| C. | B点溶液中:c(Na+)>c(OH-)>c(CH3COO-) | |
| D. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.050mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com