
研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 ______ 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发)。
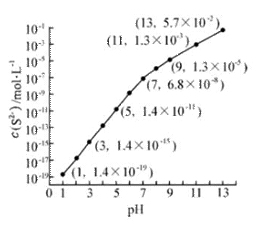
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3) 25℃,两种酸的电离平衡常数如右表。
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
【答案】(15分)
(1)① ;②C+2H2SO4(浓)
;②C+2H2SO4(浓) 2SO2↑+CO2↑+2H2O;
2SO2↑+CO2↑+2H2O;
(2)①0.043;②5。
(3)①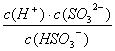 ;②c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);③H2SO3+HCO3-=HSO3-+CO2↑+H2O。
;②c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);③H2SO3+HCO3-=HSO3-+CO2↑+H2O。
 【考点定位】考查元素原子结构示意图的书写、物质性质的化学方程式书写、盐的水解平衡、弱电解质电离平衡、沉淀溶解平衡的知识在离子浓度大小比较的应用。
【考点定位】考查元素原子结构示意图的书写、物质性质的化学方程式书写、盐的水解平衡、弱电解质电离平衡、沉淀溶解平衡的知识在离子浓度大小比较的应用。
【名师点睛】物质的结构决定物质的性质。元素的性质由元素的原子结构决定,了解元素在发生反应时是原子的最外层电子发生变化,原子核不发生变化。原子失去或获得电子形成离子。从而得到相应的离子或原子结构示意图,掌握浓硫酸有三大特性:吸水性、脱水性、强氧化性,再根据氧化还原反应中元素的化合价升降总数与电子得失数目相等的守恒规律,写出物质反应时的化学方程式。在比较溶液中离子浓度大小关系时,要考虑盐的水解平衡、水等弱电解质的电离平衡,并结合元素的原子守恒、电荷守恒及水电离平衡的质子守恒关系进行。弄清坐标系中横坐标、纵坐标的含义,认识离子浓度与溶液pH的转化,了解弱电解质的电离平衡、沉淀溶解平衡平衡都遵循化学平衡移动原理,应用平衡移动原理分析化学平衡常数、沉淀形成的pH及微粒浓度大小比较。掌握物质的化学性质、平衡移动原理、盐的水解规律是本题的关键.


科目:高中化学 来源: 题型:
下列各项表述,正确的是( )
A. 互为同系物
B.2,2,4,4四甲基己烷若由炔烃加氢而来,则该炔烃为2,2,4,4四甲基1己炔
C.当降冰片烷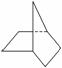 发生一氯取代时,能生成3种沸点不同的产物
发生一氯取代时,能生成3种沸点不同的产物
 |
D.与 互为同分异构体的芳香族化合物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
“烂版液”是制印刷锌版时,用稀硝酸腐蚀锌版后得到的“废液”(含有少量的Cl-、Fe3+)。某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:

已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是______(填化学式,下同)。
(2)在操作①中保持pH=8的目的是__________________________________________。
(3)沉淀Ⅰ的主要成分是____________。
(4)操作③中加热煮沸的目的是________________;此步操作的理论依据是
________________________________________________________________________。
(5)操作④保持pH=2的目的是____________;此步操作中所用的主要仪器是
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是( )
A.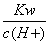 <1.0×10-7mol/L
<1.0×10-7mol/L
B.c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3)
C.c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+2 c(CO32-)
D.c(Cl-)> c(NH4+)> c(HCO3-)> c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023
B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
C.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
D.一定条件下反应N2+3H2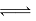 2NH3达到平衡时,3v正(H2)=2v逆(NH3)
2NH3达到平衡时,3v正(H2)=2v逆(NH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)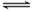
 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 mol·L-1的氨水中加入少量的NH4Cl固体,溶液的PH (填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
 (2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
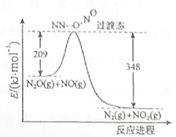
(3)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2, 其△H= kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
16.8g NaHCO3和7.8g Na2O2在密闭容器中灼烧,充分反应后,将密闭容器保持温度为500℃.最后容器内的物质是()
| A. | Na2CO3、Na2O2和O2 | B. | Na2CO3、O2和H2O(g) | |
| C. | Na2CO3、CO2、O2和H2O(g) | D. | NaHCO3、Na2CO3和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:
S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) ΔH= x kJ·mol-1
已知硫的燃烧热ΔH1= a kJ·mol-1
S(s)+2K(s)==K2S(s) ΔH2= b kJ·mol-1
2K(s)+N2(g)+3O2(g)==2KNO3(s) ΔH3= c kJ·mol-1
则x为( )
A.3a+b-c B.c +3a-b C.a+b-c  D.c+a-b
D.c+a-b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com