
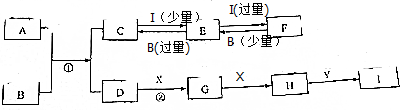
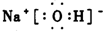 ;
;分析 X是一种气体单质,所含元素在地壳中含量最多,则I为O2;Y是一种常见的无色液体,应为H2O;B是一种常见的强碱,焰色反应呈黄色,应为NaOH;湿润的红色石蕊试纸遇气体D变蓝,应为NH3,由转化关系可知G为NO,H为NO2,I是一种强酸,应为HNO3,可说明A中含有N元素,且是由两种元素组成的化合物,其摩尔质量为4lg/mol,可知A应为AlN,则C为NaAlO2,E为Al(OH)3,F为Al(NO3)3,以此解答该题.
解答 解:X是一种气体单质,所含元素在地壳中含量最多,则I为O2;Y是一种常见的无色液体,应为H2O;B是一种常见的强碱,焰色反应呈黄色,应为NaOH;湿润的红色石蕊试纸遇气体D变蓝,应为NH3,由转化关系可知G为NO,H为NO2,I是一种强酸,应为HNO3,可说明A中含有N元素,且是由两种元素组成的化合物,其摩尔质量为4lg/mol,可知A应为AlN,则C为NaAlO2,E为Al(OH)3,F为Al(NO3)3,
(1)由以上分析可知E为Al(OH)3,故答案为:Al(OH)3;
(2)B为NaOH,电子式为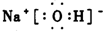 ,故答案为:
,故答案为: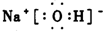 ;
;
(3)反肉①为AlN与氢氧化钠的反应,生成偏铝酸钠和氨气,反应的离子方程式为AlN+OH-+H2O=AlO2-+NH3,故答案为:AlN+OH-+H2O=AlO2-+NH3;
(4)反应②为氨气的催化氧化,方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
点评 本题考查了物质转化关系分析判断,主要是铝及其化合物性质,氮及其化合物性质的分析应用,注意反应特征的理解应用是解题关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①②④⑤ | C. | ①②⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:
空气质量日报中有一项重要检测指标是SO2的含量,结合所学知识回答下列问题.工业制硫酸的过程中,SO2催化氧化的原理为:| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| SO2 | O2 | SO2 | O2 | ||
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加稀硝酸后过滤,除去混在铜粉中的少量镁粉和铝粉 | |
| B. | 利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液 | |
| C. | 用溶解、过滤的方法分离CaCl2和NaCl固体混合物 | |
| D. | 用澄清石灰水试液鉴别SO2和CO2两种气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com