


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
| A、相同条件下,2mol SO2(g)和1mol O2(g)所具有的能量小于2mol SO3(g)所具有的能量 |
| B、将2mol SO2(g)和1mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
| C、增大压强或升高温度,该平衡都向逆反应方向移动 |
| D、将一定量SO2(g)和O2(g)置于密闭容器中充分反应放热Q kJ,此时有2mol SO2(g)被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| a | |||||||||||||||||
| b | c | d | e | ||||||||||||||
| f | g | ||||||||||||||||
| h | i | ||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
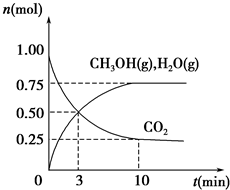 如何降低大气中CO2的含量及有效地开发利用CO2是当前科学家研究的重要课题.
如何降低大气中CO2的含量及有效地开发利用CO2是当前科学家研究的重要课题.温度(K) CO2转化率/(%)
| 500 | 600 | 700 | 800 | ||
| 1.5 | 45 | 33 | 20 | 12 | ||
| 2 | 60 | 43 | 28 | 15 | ||
| 3 | 83 | 62 | 37 | 22 |
| n(H2) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 反应CO(g)+H2O(g)?CO2(g)+H2(g)进行过程中的能量变化如图所示.回答下列问题:
反应CO(g)+H2O(g)?CO2(g)+H2(g)进行过程中的能量变化如图所示.回答下列问题:| 组别 | 温度(℃) | 起始浓度(mol/L) | 反应达平衡时所需时间(min) | 平衡浓度(mol/L) c(CO2)或c(H2) | |
| c(CO) | c(H2O) | ||||
| Ⅰ | 800 | 1.00 | 1.00 | 10 | 0.50 |
| Ⅱ | 800 | 1.00 | 4.00 | t2 | c2 |
| Ⅲ | 800 | 1.00 | 1.00 | 1 | 0.50 |
| Ⅳ | 1000 | 1.00 | 1.00 | 8 | 0.40 |
| Ⅴ | 1000 | 2.00 | 2.00 | t5 | c5 |

查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上电解制碱的技术是用阳离子交换膜法,主要原料是饱和食盐水.图为阳离子交换膜法电解原理示意图:
工业上电解制碱的技术是用阳离子交换膜法,主要原料是饱和食盐水.图为阳离子交换膜法电解原理示意图:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com