
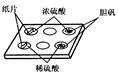
科目:高中化学 来源:不详 题型:实验题
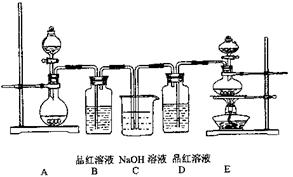
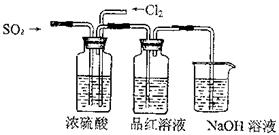
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
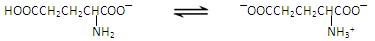
| A.NaOH溶液、氨水、AgNO3溶液 | B.H2SO4溶液、氨水、AgNO3溶液 |
| C.NaOH溶液、CuSO4溶液 | D.H2SO4溶液、CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
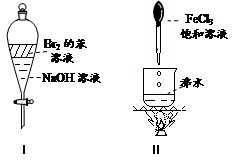
| A.实验Ⅰ:振荡后静止,上层溶液颜色逐渐消失 |
| B.实验Ⅱ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
| C.向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,紫色逐渐消失 |
| D.向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再滴加几滴新制Cu(OH)2浊液,加热,有红色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 名称 | 乙二酸 | 乙二酸晶体 |
| 分子式 | H2C2O4 | H2C2O4·2H2O |
| 颜色状态 | 无色固体 | 无色晶体 |
| 溶解度(g) | 8.6(20℃) | — |
| 熔点(℃) | 189.5 | 101.5 |
| 密度(g·cm-3) | 1.900 | 1.650 |
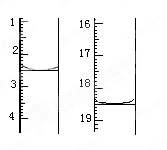
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
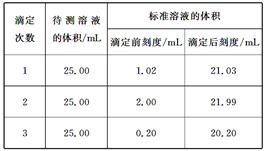
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向浑浊的苯酚试液中加入饱和Na2CO3溶液 | 溶液变澄清 | 酸性:苯酚>碳酸 |
| B | AgCl沉淀中滴入Na2S溶液 | 白色沉淀变黑色 | Ag2S比AgCl更难溶 |
| C | 向AlCl3溶液中滴入适量NaOH溶液 | 产生白色沉淀 | Al(OH)3不溶于碱 |
| D | 用玻璃棒蘸取某溶液在酒精喷灯上灼烧 | 火焰呈黄色 | 说明该溶液中一定含钠元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
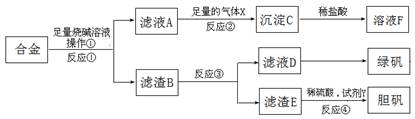
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com