
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是( )
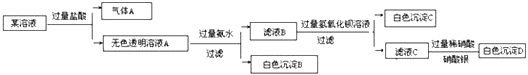
A. 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl-四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++3OH-=Al(OH)3↓
【答案】C
【解析】某溶液加入过量的盐酸后产生气体,说明有碳酸根离子,则钡离子铁离子和铜离子都不存在,溶液A加入过量的氨水产生白色沉淀,则说明原溶液中有偏铝酸根离子,沉淀为氢氧化铝,滤液B加入过量的氢氧化钡产生白色沉淀,说明原溶液中有硫酸根离子,滤液C加入过量的稀硝酸和硝酸银,产生白色沉淀,因为最初加入盐酸,不能说明原溶液中是否有氯离子。A. 通过分析,原溶液中一定有偏铝酸根离子,碳酸根离子,硫酸根离子,钠离子,不能确定氯离子,故错误;B. 气体A的化学式是CO2,其电子式为![]() ,故错误;C. 通过分析可知原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+,故正确;D. 生成沉淀B的离子方程式为:Al3++3NH3H2O=Al(OH)3↓+3NH4+,故错误。故选C。
,故错误;C. 通过分析可知原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+,故正确;D. 生成沉淀B的离子方程式为:Al3++3NH3H2O=Al(OH)3↓+3NH4+,故错误。故选C。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子在无色溶液中能大量共存的是
A.H+、Cl-、SO42-、K+B.K+、H+、Na+、HCO3-
C.Cu2+、K+、SO42-、Cl-D.Ag+、NO3-、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较不同的催化剂对H2O2分解反应的催化效果,甲乙两组同学分别设计了如图1、图2所示的实验.下列叙述中不正确的是( ) 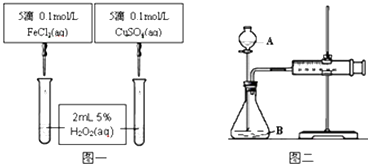
A.图1实验可通过观察产生气泡快慢来比较反应速率的大小
B.若图1所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图2装置可测定反应产生的气体体积
D.为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图向A,B中均充入1molX、1moIY,起始时A,B的体积相等都等于aL.在相同温度压强和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)2Z(g)+W(g);△H<0.达平衡时,A的体积为1.4aL.下列说法错误的是( ) 
A.反应速率:v(B)>v(A)
B.A容器中X的转化率为80%
C.平衡时的压强:PB=PA
D.平衡时向A容器中充入与反应无关的气体M,能减慢A容器内化学反应的速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:报据下列有关图象,回答有关问题:
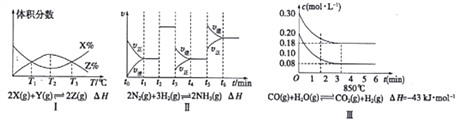
(1)由图I知,该反应的△H__________0(填“>”或“<”〉)
(2)由图Ⅱ知,反应在________时刻,NH3体枳分数最大(填t1~t2或t2~t3或t3~t4或t4~t5或t5~t6)
(3)图Ⅲ表示在10L容器、850℃时的反应,由图知,到4min时,反应放出的热量为___________。
Ⅱ: 25℃时,将体积为Va、pH=ɑ的某一元强酸与体积为Vb、pH=b的某一元强碱混合,且己知ɑ=0.56,
Va请完成下列各题。
(1)ɑ是否可以等于3 (填“是”或“否”)____________。
(2)若a+b=13,酸是盐酸,碱是KOH,现用盐酸滴定50.00mLKOH溶液,当滴定到溶液的pH=2时,消耗盐酸11.11mL。则b=___________。
(3)若己知酸是强酸,碱是强碱,酸和碱恰好中和,则ɑ的取值范围是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.0kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) △H =-129.0kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为______________。
(2)将1.0molCH4和2.0molH2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如下图。
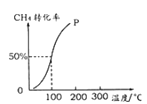
假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为_______。
(3)在压强为0.1MPa、温度为300℃条件下,将amolCO与3amol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的![]() ,其他条件不变,对平衡体系产生的影响是__________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是__________(填字母序号)。
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡![]() 减小 E.平衡常数K增大
减小 E.平衡常数K增大
(4)1mol甲醇完全燃烧产生气体通入1L1.5mol/L的NaOH溶液反应,反应后的溶液中各离子浓度大小关系为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中所用仪器合理的是
A. 用 10 mL 量筒量取 5.2 mL 盐酸
B. 用 100 mL 量筒量取 5.2 mL 盐酸
C. 用托盘天平称取 25.02 g NaCl
D. 用 100 mL 容量瓶配制 50 mL 0.1 mol/L 的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工原料。
Ⅰ、某学习小组同学设计了下图所示的实验装置(部分夹持仪器未画出),进行氨气实验室制备且探究氨气的还原性及产物的检验。
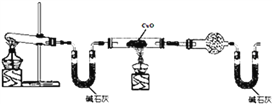
实验现象为:黑色CuO变为红色;干燥管中无水CuSO4粉末变为蓝色;同时生成一种无色无味无污染的气体。
(1)请写出大试管中反应的化学方程式_______________________________________。
(2)请写出氨气与CuO反应的化学方程式_________________________________________。
(3)该装置存在明显缺陷,请指出存在的问题______________________。
Ⅱ、哈伯因为将氮气和氢气在一定条件下合成氨气的成果面获得1918年诺贝尔化学奖。现将1molN2和3molH2充入一恒容的密闭容器中,使其在一定条件下达到平衡N2+3H2![]() 2NH3,下列哪些状态一定是达到平衡的状态?(_____)
2NH3,下列哪些状态一定是达到平衡的状态?(_____)
A.混合气体的平均相对分子质量不随时间改变而改变的状态
B.N2、H2、NH3的总物质的量不随时间改变而改变的状态
C.混合气体的密度不随时间改变而改变的状态
D.单位时间内0.1molNH3分解的同时,有0.05molN2生成的状态
Ⅲ、下图是一种电化学制备NH3的装置,图中陶瓷在高温时可以传输H+。
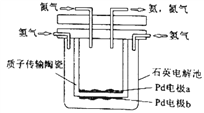
(1)H+经质子传输陶瓷由_____________流向_______________。(选填“a”或“b”)
(2)阴极发生的电极反应为_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com