
【题目】在固定容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
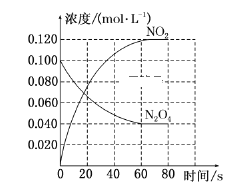
(1)反应的ΔH________(填“大于”或“小于”)0;100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应速率v(N2O4)为______________________________。
(2)100 ℃时达到平衡后,改变反应温度为T,c(N2O4)降低,经10 s又达到平衡。
①T________(填“大于”或“小于”)100 ℃,判断理由是_____________________;
②100 ℃时达到平衡后,向容器中再充入0.20 mol NO2气体,新平衡建立后,NO2的体积分数________(填“增大”“不变”或“减小”)。
(3)温度T时反应达平衡后,将反应容器的容积减小一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是_____________________________________________。
【答案】大于 0.001 0 mol·L-1·s-1 大于 正反应方向吸热,平衡向吸热方向移动,故温度升高 减小 逆反应 对气体分子数增大的反应,增大压强平衡向逆反应方向移动
【解析】
(1)根据温度对平衡状态的影响分析;根据υ=△c/△t计算;
(2)根据外界条件对平衡状态的影响分析。
(1)根据信息,升高温度,混合气体的颜色变深,说明平衡向正反应方向进行,根据勒夏特列原理,正反应方向为吸热反应,即△H>0;反应速率等于变化浓度和时间的比值,υ(N2O4)=(0.1-0.04)mol/L÷60 s=0.0010 mol/(L·s);
(2)①改变温度,c(N2O4)降低,说明平衡向正反应方向进行。由于正反应是吸热反应,根据勒夏特列原理,应是升高温度,即T>100℃;
②恒容状态下,再充入NO2,相当于在原来的基础上加压,平衡应向体积减小的方向移动,平衡向逆反应方向移动,因此新平衡建立后,NO2的体积分数减小;
(3)容积减少一半,压强增大,根据勒夏特列原理,增大压强,平衡向体积减小方向进行,即向逆反应方向移动。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】硅铁合金广泛应用于冶金工业,可用于铸铁时的脱氧剂、添加剂等,回答下列问题:
(1)基态Fe原子价层电子的电子排布图为________,基态Si原子电子占据最高能级的电子云轮廓图为________形。
(2)绿帘石的组成为![]() ,将其改写成氧化物的形式为_____________.
,将其改写成氧化物的形式为_____________.
(3)![]() 分子的中心原子的价层电子对数为________,分子的立体构型为________;四卤化硅的熔、沸点如下,分析其变化规律及原因________________________________。
分子的中心原子的价层电子对数为________,分子的立体构型为________;四卤化硅的熔、沸点如下,分析其变化规律及原因________________________________。
|
|
|
| |
熔点/K | 182.8 | 202.7 | 278.5 | 393.6 |
沸点/K | 177.4 | 330.1 | 408 | 460.6 |
(4)![]() 可与乙二胺(
可与乙二胺(![]() ,简写为en)发生如下反应:
,简写为en)发生如下反应:![]()
![]() 。
。![]() 的中心离子的配位数为________;
的中心离子的配位数为________;![]() 中的配位原子为________。
中的配位原子为________。
(5)在硅酸盐中,![]() 四面体(图
四面体(图
|
|
图a | 图b |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于四个“封管实验”(夹持装置未画出)的说法正确的是( )

A.加热时,①中上部汇集了 NH4Cl 固体,说明 NH4Cl 的热稳定性比较好
B.加热时,②中溶液变红,冷却后又都变为无色
C.加热时,③中溶液变红,冷却后红色褪去,体现了 SO2 的漂白性
D.加热时,④中上部聚集了固体碘,说明碘的热稳定性较差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某可逆反应mA(g)+nB(g)![]() pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
pC(g)在密闭容器中进行,右图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是
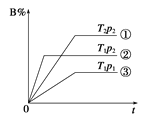
A.T1<T2 p1>p2 m+n>p 放热反应
B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应
D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是按原子序数由小到大排列的前20号元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1:2。在一定条件下,各物质之间的相互转化关系如右(部分产物未列出):
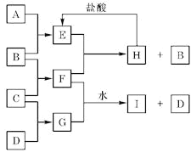
(1)A是_____,C是______ (填元素名称)。
(2)H与盐酸反应生成 E 的化学方程式是_________。
(3)E与F反应的化学方程式是___________。
(4)F与G的水溶液反应生成I和D的离子方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
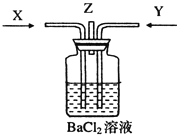
A. 洗气瓶中产生的沉淀中有碳酸钡 B. 在Z导管出来的气体中无二氧化碳
C. 洗气瓶中产生的沉淀是硫酸钡 D. 洗气瓶中无沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H是合成抗炎药洛索洛芬钠的关键中间体,它的一种合成路线如下:

回答下列问题:
(1)A的名称是____,H中官能团名称是____;
(2)反应①的反应条件为____;
(3)反应⑥的化学方程式为________;反应类型为____。
(4)反应⑦除生成H外,还生成了另一种有机产物的结构简式为____。
(5)符合下列条件的G的同分异构体有____种。
I.能发生银镜反应 Ⅱ.苯环上一氯取代物只有一种 Ⅲ.核磁共振氢谱有4组峰
(6)仿照H的合成路线,设计一种由B合成![]() 的合成路线___。
的合成路线___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置所示的实验中,不能达到实验目的是
|
|
|
|
A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)< ρ(钠) < ρ(水) | C.探究氧化性: KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3的热稳定性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。根据已知信息回答下列问题:
(1)已知:P和Cl2分两步反应生成1mol PCl5的热化学方程式:
P(s)+3/2Cl2(g)![]() PCl3(g) △H1=-306kJ/mol
PCl3(g) △H1=-306kJ/mol
Cl2(g)+PCl3(g)![]() PCl5(g) △H2=-93kJ/mol
PCl5(g) △H2=-93kJ/mol
①P和Cl2一步反应生成1molPCl5的△H3=______________ kJ/mol。
②工业上制备PCl5通常也分两步进行,通常将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5,原因是____________________________________________。
③PCl5与足量水充分反应,最终生成两种酸,其中一种是P的最高价含氧酸,其化学方程
式是________________________________________________________。
(2)反应PCl3(g)+Cl2(g)![]() PCl5(g)在容积为10L的密闭容器中进行。起始时PCl3和Cl2均为0.2mol,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
PCl5(g)在容积为10L的密闭容器中进行。起始时PCl3和Cl2均为0.2mol,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
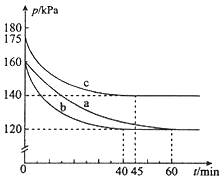
温馨提示:同温同容下的气体,压强之比就等于物质的量之比
①已知实验b平衡时气体的总物质的量为0.30mol,计算实验b反应开始至达到平衡时的反应速率v(PCl5)=_______________,PCl3的平衡转化率为__________________。
②图中3组实验从反应开始至达到平衡时的反应速率v(PCl5)由小到大的次序为____(填实验序号);与实验a相比,c组改变的实验条件是升高温度,判断依据是_________,若α表示PCl3的平衡转化率,实验a和c的平衡转化率:αa______αc(填“<”或“>”);b组改变的实验条件是加入了催化剂,判断依据是_______________________________。
③用p0表示开始时总压强,p表示平衡时总压强,则α(表示PCl3的平衡转化率)的表达式为____(用p0,p表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com