
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法I | 用碳粉在高温条件下还原CuO |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
| 方法III | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
分析 (1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数作相应的加减;
(2)在加热条件下,C与CuO也能生成Cu;
(3)液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,根据得失电子守恒分析;
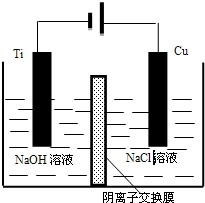
(4)阴极上氢离子得电子生成氢气,阳极上Cu失电子生成Cu2O;
(5)a.根据温度对化学平衡移动的影响知识来回答;
b.根据反应速率v=$\frac{△c}{△t}$来计算;
c.催化剂不会引起化学平衡状态的改变,会使反应速率加快,活性越高,速率越快;
d.k只与温度有关,温度越高,k越大.
解答 解:(1)已知:①2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s);△H=-akJ•mol-1,
②C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-bkJ•mol-1,
③Cu(s)+$\frac{1}{2}$O2(g)=CuO(s);△H=-ckJ•mol-1
由盖斯定律可知,①-③×2+②得2CuO(s)+C(s)=Cu2O(s)+CO(g);△H=(2c-a-b)kJ•mol-1;
故答案为:2c-a-b;
(2)在加热条件下,C与CuO也能生成Cu,所以若温度不当,会生成Cu,
故答案为:若温度不当,会生成Cu;
(3)液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,其反应的方程式为:4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑;
故答案为:4Cu(OH)2+N2H4$\frac{\underline{\;加热\;}}{\;}$2Cu2O+6H2O+N2↑;
(4)阴极上氢离子得电子生成氢气,阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极发生氧化反应,碱性条件下Cu在阳极失去电子得到Cu2O与H2O,阳极电极反应式为:2Cu-2e-+2OH-=Cu2O+H2O;
故答案为:阴极电极反应:2H++2e-=H2↑,c(OH-)增大,通过阴离子交换膜进入阳极室,阳极电极反应:2 Cu-2e-+2OH-=Cu2O+H2O,获得Cu2O;
(5)a.实验温度越高达到化学平衡时水蒸气转化率越大,②和③相比,③转化率高,所以T2>T1,故a错误;
b.实验①前20min的平均反应速率 v(H2)=$\frac{△c}{△t}$=$\frac{0.05mol/L-0.0486mol/L}{20min}$=7×10-5 mol•L-1 min-1,则v(O2)=$\frac{1}{2}$v(H2)=3.5×10-5mol/(L.min),故b错误;
c.②③化学平衡状态未改变,反应速率加快,则是加入了催化剂,催化剂的活性越高,速率越快,在相等时间内,③中水蒸气的浓度变化比②快,则实验②比实验①所用的Cu2O催化效率高,故c正确;
d.该反应为吸热反应,温度越高,k越大,由a分析可知,T2>T1,所以实验①、②、③的化学平衡常数的关系:K1=K2<K3,故d正确;
故答案为:cd.
点评 本题考查盖斯定律的应用、电解原理的应用、氧化还原反应方程式的书写和配平、化学反应速率的计算以及化学平衡移动、平衡常数等,题目综合性较大,难度中等,是对知识的综合运用,注意基础知识的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 中国古代利用明矾溶液淸除铜镜表面的铜锈,是利用了明矾的酸性 | |
| B. | 碘是人体内必须的微量元素,所以富含高碘酸钾的食物适合所有人群 | |
| C. | “光化学烟雾”“臭氧空洞”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| D. | 用加入足量氢氧化钠溶液共热的方法可以区分地沟油与矿物油 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
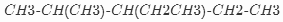 的名称是2-甲基-3-乙基戊烷.
的名称是2-甲基-3-乙基戊烷. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
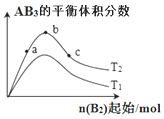 某化学科研小组研究在其它条件不变时,改变某一条件对化学反应:A2(g)+3B2(g)?2AB3(g)的平衡状态的影响时,得到如图所示的变化关系(图中T表示温度,n表示物质的量).下列推论正确的是( )
某化学科研小组研究在其它条件不变时,改变某一条件对化学反应:A2(g)+3B2(g)?2AB3(g)的平衡状态的影响时,得到如图所示的变化关系(图中T表示温度,n表示物质的量).下列推论正确的是( )| A. | 反应速率a>b>c | |
| B. | 若T2>T1,则正反应一定是放热反应 | |
| C. | 达到平衡时,AB3的物质的量大小关系:c>b>a | |
| D. | 达到平衡时,A2转化率的大小关系:a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将2.4g炭完全转化为水煤气,然后再充分燃烧,整个过程放出热量39.35kJ | |
| B. | C的燃烧热为-110.5kJ/mol | |
| C. | H2的燃烧热为-241.8kJ/mol | |
| D. | 由反应③可知,反应过程中转移5mol电子且生成液态水时放出的热量大于604.5kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入过量H2S:H+、Fe2+、Al3+、SO42- | |
| B. | 通入过量氨气:NH4+、A1O2-、OH-、SO42- | |
| C. | 加入过量NaC1O溶液:Fe3+、Na+、ClO-、SO42- | |
| D. | 加入过量NaOH溶液:Na+、A1O2-、OH-、SO42-、SiO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com