
燃烧1 g乙炔生成二氧化碳和液态水,放出热量50 kJ,则这一反应的热化学反应方程式为( )
A.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH=+50 kJ·mol-1
B.C2H2(g)+5/2O2(g)===2CO2(g)+H2O(l)
ΔH=-1 300 kJ
C.2C2H2+5O2===4CO2+2H2O ΔH=-2 600 kJ
D.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH=-2 600 kJ·mol-1
科目:高中化学 来源: 题型:
已知:乙醇、1,2二溴乙烷、乙醚的有关物理性质如下表所示。
| 乙醇 | 1,2二溴乙烷 | 乙醚 | |
| 通常状况 下的状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
| 熔点/℃ | -130 | 9 | -116 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
某化学小组拟用乙醇、溴等为原料在实验室制备少量的1,2二溴乙烷,实验装置如图所示(装置A中的加热部分的仪器装置省略没有画出)。
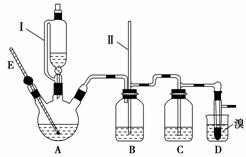
(1)仪器E的名称是_______________________________________________。
(2)仪器I是漏斗,其左部的玻璃管的作用是________(填字母)。
a.使漏斗中液体容易滴下
b.有利于吸收气体杂质
c.防止A中三颈烧瓶里的液体爆沸
(3)实验时,A中三颈烧瓶里放入几片碎瓷片的目的是__________________。
加热反应过程中,三颈烧瓶里除生成乙烯外,还可能生成的有机副产物主要是__________________________________________________________________。
(4)反应过程中,若B中长玻璃导管(II)里的液面上升,则说明可能是由于________(填“D中 出现堵塞”或“C中杂质已除尽”)造成的。
(5)反应过程中, D中需用冷水冷却盛有液溴的试管, 其主要目的是________。
说明制备1,2二溴乙烷的反应已经结束的实验现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下面的反应路线及所给信息填空:
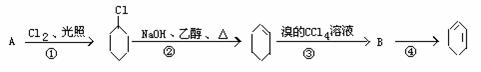
⑴A的结构简式是 ,名称是________________________
⑵① 的反应类型 ② 的反应类型_______________________
⑶反应④的化学方程式_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)写出下列化合物的名称或结构简式:
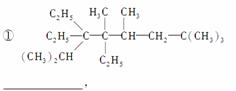
②C(CH3)CHCH2CH2______________,
③CH2===CHCOOH______________,
④2,5二甲基 2,4己二烯的结构简式: ______________________________
________________________________________________________________________。
(2)麻黄素又称黄碱,是我国特定的中药材麻黄中所含有的一种生物碱,经我国科学家研究发现其结构如下:
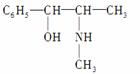
①麻黄素中含氧官能团的名称是________,属于________类(填“醇”或“酚”)。
②下列各物质:
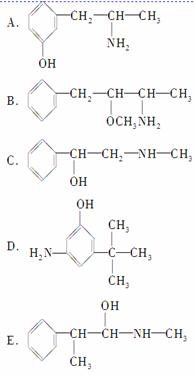
与麻黄素互为同分异构体的是________(填字母,下同),互为同系物的是________
查看答案和解析>>
科目:高中化学 来源: 题型:
N4的分子结构类似白磷分子,它的结构如图所示,已知断裂1 mol N—N键需要吸收167 kJ热量,生成1 mol N≡N键需放出942 kJ热量。根据以上信息和数据,下列说法中正确的是( )
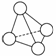
A.1 mol N4气体转变为N2将放出775 kJ热量
B.1 mol N4气体转变为N2将放出882 kJ热量
C.1 mol N4气体转变为N2将吸收775 kJ热量
D.1 mol N4气体转变为N2将吸收882 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
①2C(s)+O2(g)===2CO(g)
ΔH=-221.0 kJ·mol-1;
②2H2(g)+O2(g)===2H2O(g)
ΔH=-483.6 kJ·mol-1。
则制备水煤气的反应C(s)+H2O(g)===CO(g)+H2(g)的ΔH为( )
A.+262.6 kJ·mol-1 B.-131.3 kJ·mol-1
C.-352.3 kJ·mol-1 D.+131.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量过氧化氢反应,
生成氮气和水蒸气,放出256.65 kJ的热量。
(1)写出肼和过氧化氢的结构式:
肼____________________,过氧化氢______________________________________。
(2)写出反应的热化学方程式:
________________________________________________________________________
________________________________________________________________________。
(3)已知H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,则16 g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________kJ。
(4)上述反应用于火箭推进剂,除释放大量热和快速产生大量气体外,还有一个很突出的优点是_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质的比较,错误的是( )
A.溶解度:小苏打 < 苏打 B.密度:溴乙烷 > 水
C.硬度:晶体硅 < 金刚石 D.碳碳键键长:乙烯 > 苯
查看答案和解析>>
科目:高中化学 来源: 题型:
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是____________。电池工作时,电子流向______________(填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是________________________________________________________________________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________________________________________________________________________。
若电解电路中通过2 mol电子,MnO2的理论产量为_________________________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com