
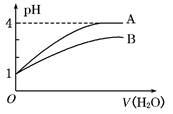
| A.A酸比B酸的电离程度小 |
| B.B酸比A酸容易电离 |
| C.A是强碱,B是弱碱 |
| D.pH=1时,B酸的物质的量浓度比A酸大 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1mol/L氢氰酸溶液的pH约为3 |
| B.HCN易溶于水 |
| C.10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应 |
| D.在相同条件下,HCN溶液的导电性比强酸溶液的弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物 |
| B.难溶于水的电解质不一定是弱电解质 |
| C.氨气的水溶液可以导电,说明氨气是电解质 |
| D.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
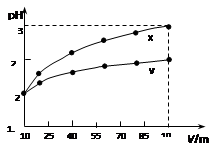
| A.x为弱酸,y为强酸 |
| B.稀释前x、y的物质的量浓度相等 |
| C.随着稀释的进行,y的电离程度减小 |
| D.等体积的x、y分别分别与足量的锌反应,y放出的氢气多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.H3PO4 3H++PO43- 3H++PO43- | B.HCO3-+H2O  H3O++CO32- H3O++CO32- |
C.CH3COONH4 CH3COO-+NH4+ CH3COO-+NH4+ | D.NaHS==Na++H++S2- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.两种溶液中,由水电离出的氢离子浓度均为1×10-11mol·L-1 |
| B.分别加水稀释100倍后,两种溶液的pH仍相同 |
| C.醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 |
| D.分别加入足量锌片,两种溶液生成H2的体积相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com