
【题目】如图装置中,容器甲内充入0.1 mol NO气体。干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积9/10,干燥管中物质的质量增加了2.24 g。随着CO2的继续通入,活塞又逐渐向右移动。下列说法中正确的是
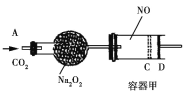
A. 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L(标准状况)
B. NO2转化为N2O4的转化率为20%
C. 容器甲中NO已反应完
D. 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01
【答案】D
【解析】
本题主要考查过氧化钠与二氧化碳反应,NO与氧气反应,2NO2![]() N2O4以及化学平衡的相关计算。CO2通入时,干燥管中发生反应:2Na2O2+2CO2===4NaOH+O2,C中发生反应:2NO+O2===2NO2
N2O4以及化学平衡的相关计算。CO2通入时,干燥管中发生反应:2Na2O2+2CO2===4NaOH+O2,C中发生反应:2NO+O2===2NO2![]() N2O4,导致气体体积减小。
N2O4,导致气体体积减小。
A.根据干燥管中固体物质的质量增加量计算通入的CO2体积;
B.根据O2计算出生成的NO2物质的量,再根据体积变化计算出转化的NO2物质的量,从而计算出转化率;
C.根据O2物质的量计算反应的NO;
D.因继续通入CO2时,体积不会缩小,即干燥管中Na2O2已反应完,活塞向右移动,2NO2![]() N2O4平衡向左移动,由此判断a值。
N2O4平衡向左移动,由此判断a值。
A.设通入标准状况下CO2气体的体积为x,产生氧气的体积为y,则:
2Na2O2+2CO2===2Na2CO3+O2 质量装置△m
2×22.4 L 22.4 L 56 g
x y 2.24 g
所以56 g:2.24g=2×22.4 L:x,解得x=1.792L,56 g:2.24g=22.4 L:y,解得:y=0.896L,即:通入二氧化碳的体积为1.792L,故A错误;
B.由A计算可知,生成氧气的物质的量:n(O2)=![]() =0.04mol,
=0.04mol,
2NO+O2===2NO2
2 1 2
0.08mol 0.04 mol0.08 mol
0.1 mol>0.08 mol,所以NO过量,生成NO2的物质的量为0.08 mol,
2NO2![]() N2O4 物质的量减少△n
N2O4 物质的量减少△n
2 1 1
0.02 mol 0.1 mol×(1-![]() )=0.01mol
)=0.01mol
所以NO2转化为N2O4的转化率为:![]() ×100%=25%,故B错误;
×100%=25%,故B错误;
C.根据B的计算可知,NO还剩余:0.1mol-0.08mol=0.02mol,故C错误;
D.活塞移至C,体积不会再减少,则干燥管中Na2O2已反应完,活塞由C向D移动,体积扩大,2NO2![]() N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol,故D正确。
N2O4平衡左移,使二者物质的量增多,活塞移至D时,气体物质的量共增加0.01 mol,因此所需CO2必小于0.01 mol,故D正确。


科目:高中化学 来源: 题型:
【题目】用14.2g无水硫酸钠配制成500mL溶液,其物质的量浓度为__________molL-1。若从中取出50 mL,其物质的量浓度为__________ molL-1。若将这50 mL溶液用水稀释到100 mL,所得溶液中![]() 的物质的量浓度为__________ molL-1,
的物质的量浓度为__________ molL-1,![]() 的物质的量浓度为__________ molL-1。
的物质的量浓度为__________ molL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将![]() 锌粒投入500mL 2mol/L的硫酸溶液中,试计算:
锌粒投入500mL 2mol/L的硫酸溶液中,试计算:
(1)产生的氢气在标准状况下的体积是__________;
(2)忽略溶液体积变化体积,反应后溶液中氢离子浓度是__________;
(3)要配制500mL 2mol/L的硫酸溶液,需用质量百分数为98%,密度为1.84g/cm3浓硫酸_______![]() 保留三位有效数字
保留三位有效数字![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10L的密闭容器中,2mol X和1mol Y进行反应:2X(g)+Y(g)![]() Z(g) ΔH<0,经20s达到平衡,生成0.5mol Z。下列说法正确的是
Z(g) ΔH<0,经20s达到平衡,生成0.5mol Z。下列说法正确的是
A.该反应平衡常数的值为1
B.将容器体积变为20L,Z的平衡浓度减小为0.025mol/L
C.以X浓度变化表示的反应速率为0.005mol/(L·s)
D.当X、Y、Z的浓度相等时,证明反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点:33℃,沸点:73℃,遇水易反应。实验室可用下图装置(部分夹持装置已略去)制取ICl3,制备的反应原理:![]() 。下列说法正确的是
。下列说法正确的是
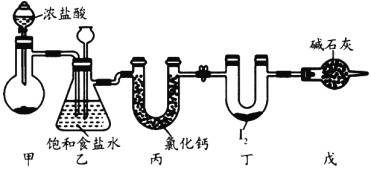
A.利用装置甲制备氯气选用的药品为二氧化锰和浓盐酸
B.装置乙中长颈漏斗液面上升说明丙装置可能发生堵塞
C.装置丙中氯化钙的作用是干燥Cl2
D.装置丁中生成ICl3,碘元素的化合价为-3价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容条件下,1 mol SiHCl3发生如下反应:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)。已知:v正=v消耗(SiHCl3)=k正x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数(仅与温度有关),x为物质的量分数。如图是不同温度下x(SiHCl3)随时间的变化。下列说法正确的是
SiH2Cl2(g)+SiCl4(g)。已知:v正=v消耗(SiHCl3)=k正x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数(仅与温度有关),x为物质的量分数。如图是不同温度下x(SiHCl3)随时间的变化。下列说法正确的是
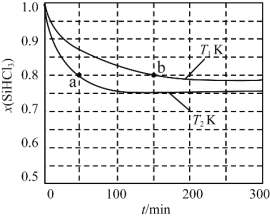
A.该反应为放热反应,v正a<v逆b
B.T1 K时平衡体系中加入Ar气,可使正、逆反应速率均增大
C.当反应进行到a处时,![]() =
=![]()
D.T2 K时平衡体系中再充入1mol SiHCl3,平衡正向移动,x(SiH2Cl2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上60%的镁来自海水,从海水中提取镁工艺流程如图所示,下列说法正确的是( )
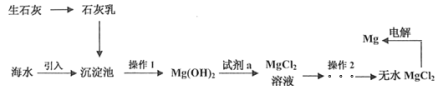
A.该工艺流程涉及的反应有分解反应、化合反应和置换反应
B.操作1为过滤,实验室里为加快过滤速度应用玻璃棒搅拌液体
C.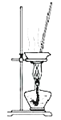 操作2实验室可用该装置对MgCl2溶液进行蒸发浓缩,再冷却结晶获得无水MgCl2
操作2实验室可用该装置对MgCl2溶液进行蒸发浓缩,再冷却结晶获得无水MgCl2
D.该工艺的优点是原料来源广泛,同时获得重要的化工原料氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为石墨电极,E、F分别为短周期相邻的两种活泼金属中的一种,且E能与NaOH溶液反应。按图接通线路,反应一段时间,当电路中通过1.0×10-3mol电子时,下列叙述正确的是( )
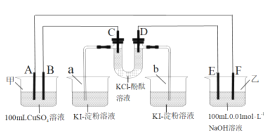
A.U型管中的D端先变红,b烧杯中的溶液会变蓝
B.a烧杯中最多有0.127gI2(KI足量)生成,甲池中的质量会减少0.04g(CuSO4溶液足量)
C.A极产生气体的体积为5.6mL,甲池溶液的pH值为2
D.E电极附近的溶液无明显现象产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】考古发掘出的古代青铜器(含铜锡等金属)表面经常出现小孔腐蚀,这是一种电化学腐蚀现象。小孔腐蚀的过程及铜腐蚀产物(铜锈)的成份如下图所示:
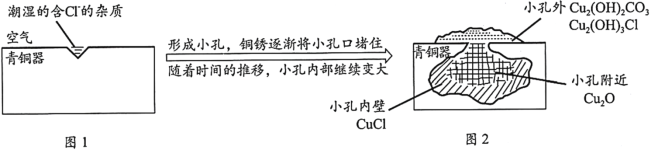
已知:2CuCl+H2O![]() Cu2O+2HCl
Cu2O+2HCl
下列分析不正确的是
A.氧气是正极反应物B.铜锈的成份与氧气浓度、pH有关
C.图2中,Cl-从小孔内向小孔外移动D.青铜中的锡也会发生电化学腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com