
设NA为阿伏加德罗常数,下面叙述正确的是 ( )
A.标准状况下,11.2L CCl4所含分子数为0.5 NA
B.1L 1mol/L的氯化钠溶液中,所含离子数为NA
C.常温下,4.4g CO2和N2O(不反应)混合物中所含有的原子数为0.3 NA
D.1mol Cl2 与足量的铁发生反应,转移的电子总数为3NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学试卷(A卷)(解析版) 题型:填空题
(7分)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:
物质 | CO | H2 | CH3OH |
浓度(mol?L-1) | 0.9 | 1.0 | 0.6 |
①混合气体的平均相对分子质量__________________________。
②列式并计算平衡常数K=__________________________。
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是__________。
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正___v逆(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(B卷)试卷(解析版) 题型:选择题
管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应(在有水蒸气存在的条件下) 2NH3+3Cl2=6HCl+N2 ,下列说法中错误的是 ( )
A.用该方法检验管道泄漏处会产生白烟
B.管道泄漏处会闻到刺激性气味
C.该反应生成1mol氮气时,转移3mol电子
D.可以用浸有稀碱液的布包裹在管道泄漏处,暂时防止氯气的危害
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(A卷)试卷(解析版) 题型:填空题
(11分)含有下列离子的五种溶液①Ag+ ②Mg2+ ③Fe2+ ④Al3+ ⑤Fe3+试回答下列问题:
(1)既能被氧化又能被还原的离子是____________(填离子符号,下同)
(2)向③中加入NaOH溶液,现象是 有关反应的离子方程式或化学方程式为 。
(3)加入过量NaOH溶液无沉淀的是_____________
(4)加铁粉溶液质量增重的是_________,溶液质量减轻的___________
(5)遇KSCN溶液呈红色的是_________________________
(6)能用来鉴别Cl–存在的离子是___________
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(A卷)试卷(解析版) 题型:选择题
下列说法正确的是( )
A.同温同压下,相同体积的物质,其物质的量一定相等
B.标准状况下气体摩尔体积约为22.4L
C.0.5 L 1 mol/L FeCl3溶液与0.2 L 1 mol/L KCl溶液中的Cl-的数目之比为15∶2
D.150 mL 1 mol/L NaCl溶液与50 mL 1 mol/L AlCl3溶液中Cl-物质的量浓度相等
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(A卷)试卷(解析版) 题型:选择题
根据下列各题所给出的数据,得出的结论错误的是( )
A.同温同压下,VLCO和H2的混合气体,完全燃烧消耗O2的体积为0.5VL
B.4.2g氮气和4.8g某单质RX所含原子个数相同,且分子个数之比为1:1,则R的相对原子质量为16
C.已知某氢氧化钠溶液中Na+与H2O的个数之比为1∶a,则可求出此溶液中氢氧化钠的质量分数为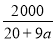 %
%
D.将98g H2SO4溶于 1 L水中,则所制得的H2SO4溶液的物质的量浓度为1 mol/L
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高二下学期期末考试化学试卷(解析版) 题型:实验题
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
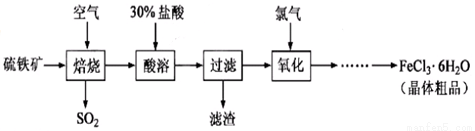
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g) ,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
2SO3(g) ,该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化后时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列与有机物的结构、性质有关的叙述正确的是( )
A.苯、油脂均不能使酸性KMnO4溶液褪色
B.甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应
C.葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体
D.乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高一下学期期末考试化学试卷(解析版) 题型:实验题
(1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。
①需要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”).
②写出该反应的离子方程式 .
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol?L﹣1KMnO4溶液装入
(填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因: 。当 ,证明达到滴定终点.
③计算:再重复上述操作2次,记录实验数据如下.
序号 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.00 | 20.10 |
2 | 1.00 | 20.90 |
3 | 0.00 | 21.10 |
则消耗KMnO4溶液的平均体积为 mL,已知H2C2O4的相对分子质量为90,则此样品的纯度为 。
④误差分析:下列操作会导致测定结果偏高的是 。
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com