
【题目】一定温度下,在某密闭容器中发生反应:2HI(g)H2(g)+I2(g),若 15 s 内 c(HI)由 0.1 mol·L-1 降到 0.07 mol·L-1,则下列说法正确的是
A.0~15 s 内用 I2 表示的平均反应速率为 v(I2)=0.015 mol·L-1·s-1
B.c(HI)由 0.07 mol ·L-1 降到 0.05 mol·L-1 所需的反应时间小于 10 s
C.升高温度,正反应速率加快,逆反应速率减慢
D.减小容器的体积,反应速率加快
【答案】D
【解析】
A.015s内c(HI)由0.1molL1降到0.07molL1,v(HI)=![]() =0.002mol/(Ls),由速率之比等于化学计量数之比可知v(I2)=0.002mol/(Ls)×
=0.002mol/(Ls),由速率之比等于化学计量数之比可知v(I2)=0.002mol/(Ls)×![]() =0.001mol/(Ls),A项错误;
=0.001mol/(Ls),A项错误;
B.若速率不变,c(HI)由0.07 molL1降到0.05 molL1所需的反应时间为![]() =10s,但随反应进行浓度减小,反应速率减小,则c(HI)由0.07 molL1降到0.05 molL1所需的反应时间大于10s,B项错误;
=10s,但随反应进行浓度减小,反应速率减小,则c(HI)由0.07 molL1降到0.05 molL1所需的反应时间大于10s,B项错误;
C.升高温度,正逆反应速率均增大,且正反应速率大于逆反应速率,平衡正向移动,C项错误;
D.减小反应体系的体积,压强增大,则化学反应速率加快,D项正确;
答案选D。


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】金属元素Fe、Ni、Pt均为周期表中同族元素,该族元素的化合物在研究和生产中有许多重要用途。
(1)Fe是常见的金属,生活中用途广泛。请回答下列问题:
①Fe在元素周期表中的位置为________________________。
②Fe的一种晶胞结构如图所示,测得晶胞边长为 a pm,则Fe原子半径为__________。
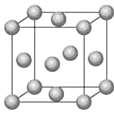
③已知:FeO晶体晶胞结构为NaCl型,与O2-距离最近且等距离的亚铁离子围成的空间构型为________。
(2)铂可与不同的配体形成多种配合物,分子式为[Pt(NH3)2Cl4]的配合物的配体是_________;该配合物有两种不同的颜色,其中橙黄色比较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,如下图所示的结构示意图中呈亮黄色的是_____(填“A”或“B”),理由是___________。
A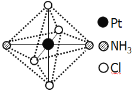 B
B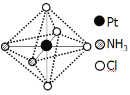
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图。
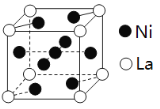
①测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为____________ (不必计算结果) 。
②储氢原理为:镧镍合金吸附H2,H2解离为原子,H原子储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心,则形成的储氢化合物的化学式为____________。
(4)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用![]() 表示,其中m、n分别代表参与形成大π键的电子数和原子个数,如苯分子中大π键表示为
表示,其中m、n分别代表参与形成大π键的电子数和原子个数,如苯分子中大π键表示为![]() 。 下列微粒中存在“离域Π键”的是__________。
。 下列微粒中存在“离域Π键”的是__________。
a.O3 b.SO42- c.H2S d.NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实对应的离子方程式正确的是
A. 用石墨电极电解饱和食盐水:Cl- + 2H2O ![]() Cl2↑+ H2↑+ OH-
Cl2↑+ H2↑+ OH-
B. 用醋酸除去水壶中的水垢:CaCO3 + 2H+ === Ca2+ + CO2↑+ H2O
C. (NH4)2Fe(SO4)2溶液中滴加过量Ba(OH)2溶液:Fe2+ + 2OH- + Ba2+ + SO42— === Fe(OH)2↓ + BaSO4↓
D. 用明矾做净水剂:Al3+ + 3H2O ![]() Al(OH)3 + 3H+
Al(OH)3 + 3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
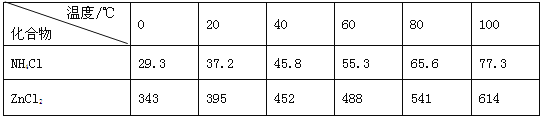
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为___,电池反应的离子方程式为___。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn___g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过___分离回收;滤渣的主要成分是MnO2、___和_______,欲从中得到较纯的MnO2,最简便的方法是___,其原理是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.电解精炼铜时,阳极泥中含有![]() 等金属
等金属
B.![]() 通入足量水中,转移电子的数目为
通入足量水中,转移电子的数目为![]()
C.反应![]() 在常温下不能自发进行,说明该反应的
在常温下不能自发进行,说明该反应的![]()
D.等质量的硫蒸气和硫粉分别在空气中完全燃烧,前者放出热量多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,用两根金属Pt作电极插入KOH溶液中,然后向两极分别通入甲烷和氧气,其电极反应式为X极:CH4+10OH--8e-=CO32—+7H2O; Y极:4H2O+2O2+8e-=8OH-。下列关于此燃料电池的说法中,错误的是
A.X为负极,Y为正极
B.该电池工作时,X极附近溶液的碱性增强
C.在标准状况下,通入 5.6 L O2完全反应后,有1 mol电子发生转移
D.工作一段时间后,KOH的物质的量减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛酸(OHC-COOH )是一种重要的精细化工产品。以高硅铸铁为惰性电极材料,用恒电势电解NaBr 溶液间接氧化乙二醛(OHC-CHO)制备乙醛酸:OHC-CHO+Br2+H2O→OHC-COOH+2HBr。装置如图所示,下列说法不正确的是( )
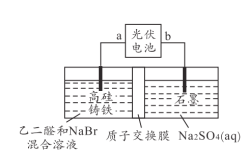
A.电极b为负极,高硅铸铁不损耗
B.阳极的电极反应式为2Br--2e-=Br2
C.光伏电池将铸铁极的电子转移到石墨极
D.电解过程中,右室溶液的pH逐渐升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种医药中间体,其合成路线如图:
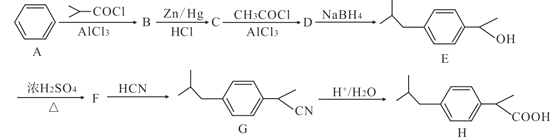
已知:
①![]()
![]()
![]()
②![]()
![]()
![]()
(1)B中所含官能团的名称是______,H的最简单同系物名称为______。
(2)B→C的反应类型是______。
(3)F的结构简式为______。
(4)C→D的化学方程式为______。
(5)芳香族化合物X是H的同分异构体,X能发生银镜反应,其核磁共振氢谱显示有5组峰,且峰面积比为12:2:2:1:1,符合要求的X的结构简式为______。
(6)已知RCOOH+SOCl→RCOCl,写出以苯和丙烯酸(CH2=CHCOOH)为原料制备![]() 的合成路线(无机试剂任选):______。
的合成路线(无机试剂任选):______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,三个容积相同的烧瓶内分别充满了干燥的NH3、HCl、NO2气体,然后分别用水作喷泉实验,假设烧瓶内的溶质不散逸,则三种溶液的物质的量浓度之比为 ( )
A. 无法比较B. 2∶2∶3C. 3∶3∶ 2D. 1∶1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com