
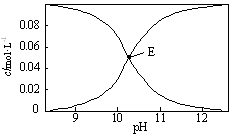
 20��ʱ������һ��c��Na2CO3��+c��NaHCO3��=0.100mol•L-1�Ļ����Һ����Һ��c��HCO3-����c��CO32-����pH�Ĺ�ϵ��ͼ��ʾ������ָ����Һ���������ʵ���Ũ�ȹ�ϵ��ȷ���ǣ�������
20��ʱ������һ��c��Na2CO3��+c��NaHCO3��=0.100mol•L-1�Ļ����Һ����Һ��c��HCO3-����c��CO32-����pH�Ĺ�ϵ��ͼ��ʾ������ָ����Һ���������ʵ���Ũ�ȹ�ϵ��ȷ���ǣ�������| A�� | pH=9����Һ�У�c��HCO3-����c��H2CO3����c��CO32-�� | |
| B�� | c��HCO3-��=c��CO32-����E����Һ�У�c��OH-��+c��CO32-����c��H+��+c��H2CO3��+0.050 mol•L-1 | |
| C�� | pH=11����Һ�У�c��Na+����2c��CO32-��+c��HCO3-�� | |
| D�� | 0.100 mol•L-1��Na2CO3��Һ�У�c��H+��+c��H2CO3��+c��HCO3-��=c��OH-�� |
���� A��pH=9����Һ����Ҫ��̼��������Һ��̼���������ˮ��̶ȴ���̼��������ӵĵ���̶ȣ�
B��E��c��HCO3-��=c��CO32-��=0.05mol/L�������Һ�е���غ������
C��pH=11����Һ�У�c��OH-����c��H+������Һ�д��ڵ���غ㣬c��OH-��+2c��CO32-��+c��HCO3-��=c��H+��+c��Na+��������
D����Һ�д��������غ㣬ˮ����������������Ӻ����������Ӵ�����ʽ��ͬ��
��� �⣺A��pH=9����Һ����Ҫ��̼��������Һ��̼���������ˮ��̶ȴ���̼��������ӵĵ���̶ȣ���Һ������Ũ�ȴ�Сc��HCO3-����c��H2CO3����c��CO32-������A��ȷ��
B��E��c��HCO3-��=c��CO32-��=0.05mol/L����Һ�д��ڵ���غ㣬c��OH-��+2c��CO32-��+c��HCO3-��=c��H+��+c��Na+���������غ�c��CO32-��+c��HCO3-��+c��H2CO3��=3c��Na+��������õ�c��OH-��+c��CO32-����c��H+��+c��H2CO3��+0.050 mol•L-1����B��ȷ��
C��pH=11����Һ�У�c��OH-����c��H+������Һ�д��ڵ���غ㣬c��OH-��+2c��CO32-��+c��HCO3-��=c��H+��+c��Na+����c��Na+����2c��CO32-��+c��HCO3-������C����
D����Һ�д��������غ㣬ˮ����������������Ӻ����������Ӵ�����ʽ��ͬ��0.100 mol•L-1��Na2CO3��Һ�У�c��H+��+2c��H2CO3��+c��HCO3-��=c��OH-������D����
��ѡAB��
���� ���⿼���˵������Һ������Ũ�ȴ�С�Ƚϡ�����غ㡢�����غ��֪ʶ�㣬���ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCl�TH++Cl- | B�� | H2SO4�T2H++SO42- | C�� | FeCl3�TFe3++Cl- | D�� | NaOH�TNa++OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����¶Ȳ��䣬��Сѹǿ | B�� | ���ֺ��º��ݣ����뺤�� | ||
| C�� | ������������ʱ�������¶� | D�� | ������������ʱ����������A |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ֱ��Ϊ1.3��10-9m �ġ���̪ݼ�����ӷ�ɢ��ˮ�����γɽ��壬��÷��ӵ�ֱ����Na+�� | |
| B�� | ��б���FeCl3��Һ�����Ƶ�Fe��OH��3���� | |
| C�� | �������������������������Һ | |
| D�� | ������ˮ�����˽�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��þ�Ͻ��Ӳ�Ƚϴ��ƼغϽ��Ӳ�Ƚ�С | |
| B�� | ��Ϊ�ƵĽ����Ա�þҪǿ�������Ƶ��۵��þҪ�� | |
| C�� | þ���û�����ͭ��Һ�е�ͭ����Ҳ���û�����ͭ��Һ�е�ͭ | |
| D�� | �ڿ����ж��ܱ���ȼ�����ɵIJ��ﶼ����������ڲ����еĻ��ϼ۶���-2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
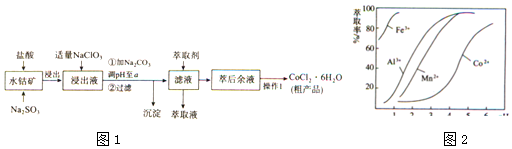
| ���� | Fe��OH��3 | Fe��OH��2 | Co��OH��2 | Al��OH��3 | Mn��OH��2 |
| ��ʼ���� | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| ��ȫ���� | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
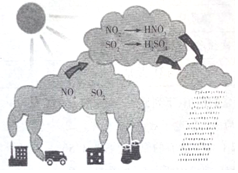
| A�� | ͼʾ���̱�ʾ�˵����������ƻ����� | |
| B�� | ͼ���漰���������Ϊ���������� | |
| C�� | �����������N���������� | |
| D�� | ͼʾ�������Ĺ������漰�ķ�Ӧ��Ϊ������ԭ��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
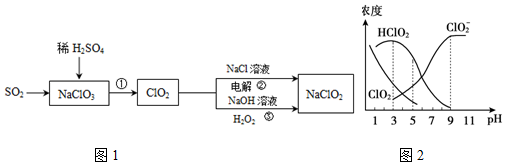
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | K+��Cl-��NO3-��S2- | B�� | K+��Fe2+��I-��SO42- | ||
| C�� | Na+��Cl-��NO3-��SO42- | D�� | K+��Ba2+��Cl-��NO3- |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com