
化学在生产和日常生活中有着重要的作用.下列有关说法正确的是( )
A. 二氧化硫有漂白性,常用作棉、麻、纸张和食品的漂白
B. 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应
C. “地沟油”经过加工处理后,可以用来制肥皂和生物柴油
D. 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的
考点: 胶体的重要性质;二氧化硫的化学性质;常见的生活环境的污染及治理;油脂的性质、组成与结构.
分析: A.二氧化硫有毒,不能漂白食品;
B.丁达尔效应是胶体的特性;
C.地沟油属于油脂,油脂可发生皂化反应制肥皂;生物柴油是以动植物油脂、废餐饮用油等为原料与甲醇在催化剂作用下,进行酯交换制成的液体燃料;
D.“食用色素”、“碘元素”、“亚硝酸盐”都是食品添加剂.
解答: 解:A.二氧化硫有毒,不能漂白食品,故A错误;
B.水玻璃是硅酸钠的水溶液,无丁达尔效应,故B错误;
C.地沟油经过皂化反应制肥皂,与甲醇在催化剂作用下进行酯交换制成生物柴油,故C正确;
D.汽车尾气污染物中含有氮的氧化物,是空气中的氮气在(发动机)高温条件下生成的,故D错误.
故选C.
点评: 本题考查化学与科学、技术、社会、环境等问题,题目难度不大,侧重对基础知识的巩固,注意对基础知识的理解掌握.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
已知(CH3)3COH在Cu作催化剂条件下不能与氧气发生催化氧化反应,某芳香烃A(C9H10)有如下转化关系:

(1)写出反应①的反应类型 ;
(2)A的同类的同分异构体还有种(不包括A) ;
(3)D中的官能团是(写名称) ;
(4)写出E的结构简式 ;
(5)写出②的化学反应方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
|
| A. | 28 g 氮气含有的原子数为NA |
|
| B. | 标准状况下,22.4 LH2O 中含有的水分子数为NA |
|
| C. | 1 mol 铁与稀硝酸反应时,失去的电子数不一定为3NA |
|
| D. | 0.5 mol/L Fe2(SO4)3 溶液中,SO42﹣ 的数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
两个惰性电极插入500mL AgNO3溶液中,通电电解.当电解液的pH从6.0变为3.0时,(设电解过程中阴极没有H2放出,且电解液在电解前后体积变化可以忽略不计)电极上析出银的质量最大为( )
|
| A. | 27 mg | B. | 54 mg | C. | 106 mg | D. | 216 mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁是4种短周期元素,它们的原子序数依次增大,其中甲和丙、乙和丁分别是同主族元素,又知乙、丁两元素的原子核中质子数之和是甲、丙两元素的原子核中质子数之和的2倍,甲元素的一种核素核内无中子.
(1)丙、丁组成的常见化合物,其水溶液呈碱性,原因是
(用离子方程式表示);
写出两种均含甲、乙、丙、丁四种元素的化合物相互间发生反应,且生成气体的离子方程式 .
(2)丁的单质能跟丙的最高价氧化物的水化物的浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式 .
(3)甲、乙、丁可形成A、B两种微粒,它们均为﹣1价双原子阴离子,且A有18个电子,B有10个电子,则A与B反应的离子方程式为 .
(4)4.0g丁单质在足量的乙单质中完全燃烧放出37.0kJ热量,写出其热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
如图示的装置中,把X溶液逐滴滴下与Y物质反应,若X为浓硫酸,Y为第三周期金属元素中常温下与水难反应的单质.Z为品红溶液.实验中观察到Z褪色.则Y为( )

A. Na B. Mg C. Al D. Mg或Al
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4═2CuI↓+13I2+12K2SO4+12H2O,下列说法正确的是( )
A. Cu(IO3)2作氧化剂,Cu(IO3)2中的铜和碘元素被还原
B. CuI既是氧化产物又是还原产物
C. 每生成1 mol CuI,有12 mol KI发生氧化反应
D. 每转移1.1 mol电子,有0.2 mol 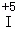 被氧化
被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
HNO3与金属反应时,还原产物可能是NO2、NO、N2O、N2或NH3的一种或几种.现有一定量的Al粉和Fe粉的混合物与100mL,稀HNO3充分反应,反应过程中无任何气放出.在反应结束后的溶液中,逐渐加入4mol•L﹣1的NaOH溶液,加入NaOH溶液的体积(mL)与产生沉淀的物质的量关系如图.请回答:
(1)与HNO3反应后Fe元素的化合价是
(2)纵坐标中A点数值是 ,B点数值是 ,原HNO3浓度是 .

查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,a、b、c…为部分元素.回答下列问题:
| a |
| ||||||||||||||||
| b | c | d | e |
| |||||||||||||
| f | g |
| |||||||||||||||
| h | i |
(1)请写出上述元素h的原子结构示意图 ;
(2)比较e、g两种元素的气态氢化物的稳定性大小 (写化学式,下同);e、g两种元素的气态氢化物熔、沸点较高的是 ,其原为 ;
(3)b2a2分子的电子式是 ,该分子中存在的σ键与π键的个数比为 ;
(4)c、d两种元素中第一电离能较大的是 (写元素符号),其原因是
;
(5)已知f的氢氧化物与水电离出的OH﹣可形成配位键,则生成的含有配位键的离子的结构式为 (标出配位键).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com