

分析 (1)原子晶体熔沸点高于分子晶体;
(2)SiO44-中价层电子对个数是4且不含孤电子对,根据价层电子对互斥理论判断该微粒空间构型;
利用均摊法计算其原子个数比,从而确定其化学式;
(3)晶格能与离子所带电荷成正比,与离子半径成反比;
(4)A. HCl中存在s-pσ键;
B.HF中存在s-pσ键;
C. SO2中存在p-pπ键;
D. SCl2中存在p-pσ键;
(5)CN-是常见的配位体,配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,铁原子最外层电子式是2、每个配体提供电子数是2,铁原子的最外层电子数和配位体提供的电子数之和为14,则2+2n=14,据此计算n.
解答 解:(1)二氧化硅是原子晶体、二氧化碳是分子晶体,原子晶体熔沸点大于分子晶体,所以二氧化硅熔沸点大于二氧化碳,
故答案为:二氧化硅是原子晶体、二氧化碳是分子晶体;
(2)SiO44-中价层电子对个数是4且不含孤电子对,所以该微粒为正四面体结构;
根据图片知,每个三角锥结构中Si原子是1个,O原子个数=2+2×$\frac{1}{2}$=3,所以硅原子和氧原子个数之比=1:3,3个O原子带6个单位负电荷,每个硅原子带4个单位正电荷,所以形成离子为[SiO3]n2n- (或SiO32-),
故答案为:正四面体;1:3;[SiO3]n2n- (或SiO32-);
(3)晶格能与离子所带电荷成正比,与离子半径成反比,所以MgO晶格能大于CaO,故选A;
镁离子和钙离子所带电荷相等但镁离子半径小于钙离子,所以氧化钙晶格能小于氧化镁,故答案为:A;
镁离子半径小于钙离子且二者电荷相等;
(4)A. HCl中存在s-pσ键,故错误;
B.HF中存在s-pσ键,故错误;
C.SO2中存在p-pπ键,故错误;
D. SCl2中存在p-pσ键,故正确;
故选D;
(5)CN-是常见的配位体,配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,铁原子最外层电子式是2、每个配体提供电子数是2,铁原子的最外层电子数和配位体提供的电子数之和为14,则2+2n=14,n=6,故答案为:6.
点评 本题考查物质结构和性质,为高频考点,涉及配合物的成键情况、共价键、晶格能、微粒空间构型判断、晶体类型判断等知识点,会利用价层电子对互斥理论判断原子杂化及微粒空间构型、会利用均摊法确定化学式等,难点是(6)题,题目难度中等.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
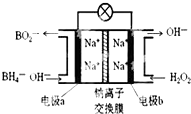 某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
某新型电池NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | 电池工作时Na+从b极区移向a极区 | |
| B. | a极上的电极反应式为:BH4-+8OH--8e-=BO2-+6H2O | |
| C. | b极上的电极反应式为:H2O2+2e-+2H+=2H2O | |
| D. | 每消耗3molH2O2,转移3mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应Ⅰ的速率增加,反应Ⅱ的速率不变 | |
| B. | 反应Ⅰ的速率不变,反应Ⅱ的速率增加 | |
| C. | 反应Ⅰ、Ⅱ的速率均增加,且反应Ⅰ的速率增加得快 | |
| D. | 反应Ⅰ、Ⅱ的速率均增加,且反应Ⅱ的速率增加得快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 | |
| C. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl常用于保存食物 | |
| B. | 烹鱼时加入少量酒、食醋,美味又营养 | |
| C. | 糖类、油脂、蛋白质均为高分子化合物 | |
| D. | 燃煤中加入CaCO3,可减少SO2气体对大气的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;⑤的反应条件是NaOH的醇溶液、加热;⑧的反应类型是加聚反应.
;⑤的反应条件是NaOH的醇溶液、加热;⑧的反应类型是加聚反应. .
. .
. )合成2-甲基-3-甲酸甲酯吲哚的反应方程式
)合成2-甲基-3-甲酸甲酯吲哚的反应方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com