
���� ��1������������ԭ��Ӧ�е�ʧ�����������ƽ����ʽ��1mol����������Ӳμ�������ԭ��Ӧ�õ�5mol���ӣ�1mol������������Ӳμ�������ԭ��Ӧʧȥ2mol���ӣ�
��2�����ݸ�����غ�����������֮��Ĺ�ϵʽ�������������Ƶ����ʵ���Ũ�ȣ�
��3������c�����⣩=$\frac{c����ע����V������}{V�����⣩}$��������������V��������Ӱ�죬�Դ��ж�Ũ�ȵ���
��� �⣺��1��1mol����������Ӳμ�������ԭ��Ӧ�õ�5mol���ӣ�1mol������������Ӳμ�������ԭ��Ӧʧȥ2mol���ӣ����Ե�ʧ���ӵ���С��������10�������������ӵļ�������2��������������ӵļ�������5������ԭ�Ӹ���ԭ���غ�����ƽ�����Ը÷���ʽΪ��2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O��
�ʴ�Ϊ��2��5��1��2��5��3��
��2�������������Ƶ����ʵ���Ũ��Ϊxmol/L��
2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O��
2mol 5mol
0.0016mol 0.02xmol ��ã�x=O.2000
�ʴ�Ϊ��0.2000��
��3��A����ʽ�ζ���ˮϴ��δ�ô���Һ��ϴ���ᵼ�����Ը������Ũ��ƫС����Ҫ����������ƫ�����V������ƫ�ⶨֵƫ��A��ȷ��
B��ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ������Һ�����ʵ������䣬��Һ��������䣬c�����⣩��Ӱ�죬��B����
C�����ܼ��첿�������ݣ��ζ�����ʧ���ᵼ�²ⶨ����������ƫ�����V������ƫ�ⶨֵƫ��C��ȷ��
D����С�Ľ���������KMnO4��Һ������ƿ�⣬���V������ƫ����c�����⣩=$\frac{c����ע����V������}{V�����⣩}$��c�����⣩ƫ��D��ȷ��
E���ζ�ǰ���ӣ��ζ����ӣ����V������ƫС������c�����⣩=$\frac{c����ע����V������}{V�����⣩}$������c�����⣩ƫС����E����
�ʴ�Ϊ��ACD��
���� ���⿼����������ԭ��Ӧ����ƽ�����ʵ������йؼ��㡢�ζ���������֪ʶ�㣬����������ԭ��Ӧ�е�ʧ�������������ƽ���ɣ�ע���������ķ�������Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ȡ��̼���ڼ�����ʽ������ũ���������������֪ʶ | |
| B�� | �û���̿Ϊ�ǽ���ɫ���ô�������Ư��ֽ����ԭ����ͬ | |
| C�� | �ȴ������ȥ���ۣ��������Ծ���ˮ��Ư�ۿ�����Ư��֯�� | |
| D�� | ��ˮ�����ķ������������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/��mol•L-1�� | 0.44 | 0.6 | 0.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | S��g��+O2��g���TSO2��g����H��-297.3kJ•mol-1 | |
| B�� | 2SO2��g���T2S��s��+2O2��g����H=+297.3kJ•mol-1 | |
| C�� | 1molSO2�ļ����ܺ�С��1molS��1molO2�ļ����ܺ� | |
| D�� | 1molSO2�������������1molS��1molO2�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
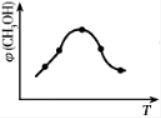
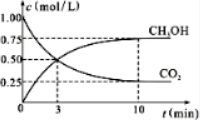
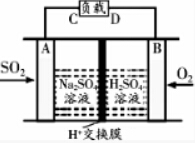
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֪H2��g��+$\frac{1}{2}$O2��g���TH2O��g������H=-241.8 kJ•mol-1����������ȼ����Ϊ241.8 kJ•mol-1 | |
| B�� | ��֪C��ʯī��s��=C�����ʯ��s������H=+1.9 kJ•mol-1����ʯī�Ƚ��ʯ�ȶ� | |
| C�� | ��֪NaOH��aq��+HCl��aq���TNaCl��aq��+H2O��l������H=-57.3 kJ•mol-1����1mol NaOH��ϡ��Һ��1mol��ϡ������ȫ�кͣ��ų�������Ҳ����57.3kJ | |
| D�� | ��֪2C��s��+2O2��g���T2CO2��g������H=a kJ•mol-1��2C��s��+O2��g���T2CO��g����H=b kJ•mol-1����a��b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com