
分析 (1)设出NO和NO2的物质的量,根据n=$\frac{V}{{V}_{m}}$计算出二者物质的量,然后结合总物质的量、总质量列式计算;
(2)根据N=nNA可知二者原子数之比等于二者所含原子的物质的量之比;
(3)根据M=$\frac{m}{n}$计算出二者平均摩尔质量,从而可知其平均相对分子质量;根据相同条件下气体密度与摩尔质量成正比计算出相对氢气的密度.
解答 解:(1)设NO和NO2的物质的量分别为x、y,标况下4.48L混合气体的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,
则:$\left\{\begin{array}{l}{x+y=0.2}\\{30x+46y=7.6}\end{array}\right.$,
解得:x=y=0.1mol,所以NO和NO2物质的量比是1:1,
故答案为:1:1;
(2)根据N=nNA可知NO和NO2原子数之比等于二者所含原子的物质的量之比=(1×2):(1×3)=2:3,
故答案为:2:3;
(3)混合气体的平均摩尔质量为:$\frac{7.6g}{0.2mol}$=38g/mol,则混合气体的平均相对分子质量是38;
相同条件下气体的密度与摩尔质量成正比,则该混合气体与氢气的相对密度=$\frac{38}{2}$=19,
故答案为:38;19.
点评 本题考查了物质的量的计算,题目难度不大,明确相对密度的含义为解答关键,注意掌握物质的量与其它物理量之间的关系,试题有利于提高学生的分析能力及化学计算能力.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题
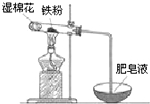 铝和铁是日常生活中用途广泛的金属.
铝和铁是日常生活中用途广泛的金属.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属,化合物 | B. | 金属氧化物,碱性氧化物 | ||
| C. | 泥沙,胶体 | D. | 单质,纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 mol CO2、CO的混合气中含有的氧原子数为1.5NA | |
| B. | 标准状况下,11.2LCCl4所含的分子数为0.5 NA | |
| C. | 25℃,1.01×105Pa,66gCO2中所含原子数为4.5NA | |
| D. | 1 mol•L-1 CuCl2溶液中含有的氯离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g镁在足量的氧气中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| C. | 氯原子数为0.2NA的氯气溶于水转移的电子数0.1NA | |
| D. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
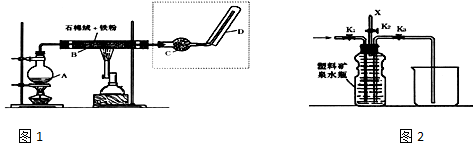
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com