
【题目】常温下,二元弱酸 H2Y 溶液中滴加 NaOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如图所示,下列有关说法错 误的是( )
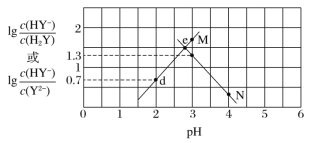
A.曲线 M 表示 pH 与 lgc(HY-)/c(H2Y)的变化关系
B.Ka2(H2Y)=10-4.3
C.d 点溶液中:c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(Na+)
D.交点 e 的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
【答案】D
【解析】
A. pH增大,表示溶液中碱性增强,溶液中H2Y减少,HY-增多,据此判断变化关系;
B. 曲线N表示lg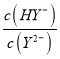 ,Ka2(H2Y)=
,Ka2(H2Y)=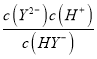 ,根据图像计算;
,根据图像计算;
C.根据电荷守恒分析;
D.交点e表示lg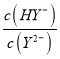 = lg
= lg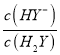 ,即c(Y2-)=c(H2Y),根据图像进行分析;
,即c(Y2-)=c(H2Y),根据图像进行分析;
A. pH增大,表示溶液中碱性增强,溶液中H2Y减少,HY-增多,因此lg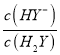 增大,则曲线M表示pH与lg
增大,则曲线M表示pH与lg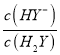 的变化关系,A项正确,不符合题意;
的变化关系,A项正确,不符合题意;
B. 曲线N表示lg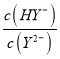 ,当pH=3时,lg
,当pH=3时,lg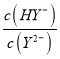 =1.3,则Ka2(H2Y)=
=1.3,则Ka2(H2Y)=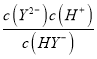 =10-3×10-1.3=10-4.3,B项正确,不符合题意;
=10-3×10-1.3=10-4.3,B项正确,不符合题意;
C. 溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(HY-)+2c(Y2-),因此c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(Na+),C项正确,不符合题意;
D. 交点e表示lg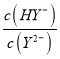 = lg
= lg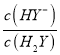 ,即c(Y2-)=c(H2Y),根据图像可知此时lg
,即c(Y2-)=c(H2Y),根据图像可知此时lg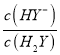 >1,所以c(HY-) >c(H2Y)=c(Y2-),D项错误,符合题意;
>1,所以c(HY-) >c(H2Y)=c(Y2-),D项错误,符合题意;
答案选D。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】化学能在一定条件下可转化为电能。
(1)如图所示装置中锌片是______(填“正极”或“负极”),其电极反应式是______。溶液中H+移向______(填“锌”或“石墨”)电极。
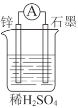
(2)下列反应通过原电池装置,可实现化学能直接转化为电能的是______(填序号)。
①2H2+O2=2H2O②HCl+NaOH=NaCl+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】柠檬烯是一种食用香料,其结构简式如图所示,下列有关柠檬烯的说法正确的是( )

A.它的一氯代物有 7 种
B.它与足量氢气反应后生成的分子中所有的碳原子可能在同一平面上
C.它与足量的溴水反应后,产物的化学式为:C10H14Br4
D.一定条件下,它可以发生加成、取代、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是一种强还原剂,用NaClO与NH3反应可用于生产肼(N2H4),其反应的化学方程式为:NaClO+2NH3= N2H4+NaCl+H2O。
⑴生产1000 g质量分数为25.6%的肼溶液最少需要___________L(标准状况)NH3。
⑵工业次氯酸钠溶液中含有氯酸钠会影响所得肼的产品质量。测定次氯酸钠样品中的氯酸钠含量的方法如下:取10.00 mL 碱性NaClO溶液试样,加入过量H2O2,将次氯酸钠完全还原(ClO3-在酸性条件下具有强氧化性,但碱性条件下几乎无氧化性),加热煮沸,冷却至室温,加入硫酸至酸性,再加入0.1000 mol·L-1 硫酸亚铁标准溶液30.00 mL,充分反应后,用0.01000 mol·L-1酸性K2Cr2O7溶液滴定至终点(Cr2O72-被还原为Cr3+),消耗该溶液20.00 mL。
①用H2O2与次氯酸钠反应的离子方程式为___________。
②实验中加热煮沸的目的是___________。
③计算样品中NaClO3的含量(以g·L-1表示),写出计算过程。___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气的制备和存储是氢氧燃料电池能否有效推广的关键技术。有人提出利用光伏发电装置电解尿素的碱性溶液来制备氢气。光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏并网发电装置,图2为电解尿素![]() 的碱性溶液制氢气的装置示意图
的碱性溶液制氢气的装置示意图![]() 电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极
电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极![]() 。
。
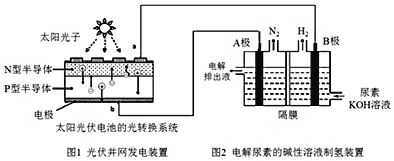
(1)图1中N型半导体为______![]() 填“正极”或“负极”
填“正极”或“负极”![]()
(2)该系统工作时,A极的电极反应式为______
(3)若A极产生![]()
![]() ,则此时B极产生______L
,则此时B极产生______L![]() 标况下
标况下![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠![]() 是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,
是工业盐的主要成分,在漂白、电镀等方面应用广泛。已知:室温下,![]() ,以木炭、浓硝酸、
,以木炭、浓硝酸、![]() 为主要原料制备亚硝酸钠的装置如图所示
为主要原料制备亚硝酸钠的装置如图所示![]() 部分夹持装置已略去
部分夹持装置已略去![]() 。下列说法正确的是( )
。下列说法正确的是( )
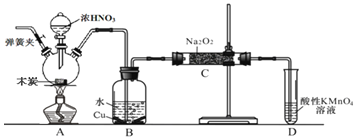
A.可以将B中药品换成NaOH溶液
B.应在B、C之间加一个盛放无水![]() 的干燥管
的干燥管
C.实验开始前先向装置中通入![]() ,实验结束时先停止通入
,实验结束时先停止通入![]() 再熄灭酒精灯
再熄灭酒精灯
D.装置D可用于尾气处理,标况下每吸收![]() L的尾气消耗
L的尾气消耗![]() mol高锰酸钾
mol高锰酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按照下列要求回答问题:
(1)电解氯化钠溶液的化学方程式:__________________________________。
(2)硫化钠水解的离子方程式:________________________________。
(3)0.1 mol/L 的碳酸钠溶液中离子浓度由大到小顺序为:__________________________。
(4)浓的 Al2(SO4)3 溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理__________________________。
(5)将25℃下 pH=12 的 Ba(OH)2 溶液aL与 pH=1的HCl溶液bL 混合,若所得混合液为中性,则 a:b= __________________________。(溶液体积变化忽略不计)。
(6)pH=3 的 NH4Cl 溶液,由水电离出的 c(H+)= __________________________。
(7)常温时,Fe(OH)3 的溶度积常数 Ksp=1×10-38,要使溶液中的 Fe3+沉淀完全(残留的 c(Fe3+)<10-5 mol·L-1),则 溶液的 pH 应大于____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较中正确的是
A. 相同浓度的三种溶液:①(NH4)2CO3溶液、②NH4HCO3溶液、③NH4NO3溶液中 c(NH4+):③>①>②
B. 相同pH的溶液:①NaClO溶液、②NaHCO3溶液、③CH3COONa溶液中 c(Na+):③>②>①
C. 同浓度、同体积的溶液:①CH3COONa溶液、②NH4Cl溶液、③NaNO3溶液中 pH:②>③>①
D. 相同浓度的溶液:①氨水、②NaOH溶液、③Ba(OH)2溶液 c(H+):②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用标准浓度氢氧化钠的溶液来滴定未知浓度的盐酸,下列操作中会使盐酸测定的浓度偏大的是( )
①碱式滴定管用蒸馏水洗净后未用标准溶液润洗
②锥形瓶中盛有少量蒸馏水,再加待测液
③酸式滴定用蒸馏水洗净后,未用盐酸润洗
④滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
⑤滴定后观察碱式滴定管读数时,俯视刻度线
A.①④B.①③C.②③D.④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com