
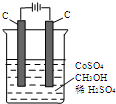
 电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+).现用如图装置模拟上述过程,则:
电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+).现用如图装置模拟上述过程,则:分析 通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
解答 解:通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,故答案为:Co2+-e-=Co3+;6Co3++CH3OH+H2O=CO2↑+6Co2++6H+.
点评 本题考查电化学的原理和离子方程式的书写等知识,学生要掌握原电池的反应原理是解本题的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.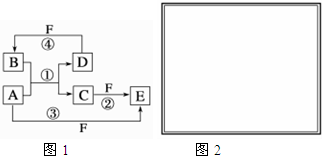
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新农村建设大量使用秸秆制取沼气,符合低碳理念 | |
| B. | 发霉的大米经过石蜡打磨后可以食用和出售 | |
| C. | 2014年西非国家爆发埃博拉病毒,双氧水、高锰酸钾溶液可以完全杀灭该病毒,其消毒原理和漂白粉消毒饮用水相同 | |
| D. | 卤水点豆腐、血液透析、静电除尘都是利用了胶体的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比例模型 :可以表示二氧化碳分子,也可以表示水分子 :可以表示二氧化碳分子,也可以表示水分子 | |
| B. | 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合溶液的pH=5,则混合溶液中由水电离出的c(H+)=1×10-5mol/L | |
| C. | 纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于-183℃时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同位素 | |
| D. | 已知 Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-4 mol•L-1的AgNO3溶液和1×10-4 mol•L-1 K2Cr04溶液混合,不会有Ag2CrO4沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④⑤ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(H2)=0.03 mol/(L•min) | B. | v(N2)=0.02mol/(L•min) | ||
| C. | v(NH3)=0.17mol/(L•min) | D. | v(NH3)=0.01mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1MgCl2溶液中的Mg2+数为nA | |
| B. | 1 mol Na2O2固体中含阴离子总数为2nA | |
| C. | 5 g质量分数为46%的乙醇溶液中,氢原子的总数为0.6 nA | |
| D. | 100 mL 12mol•L-1 浓盐酸与足量MnO2加热反应,转移电子数为1.2nA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com