
(14分)氮的化合物是中学化学的重要物质,与人类生活密切相关。
(1)金属与不同密度的硝酸溶液反应所得的还原产物比较复杂,如图所示:
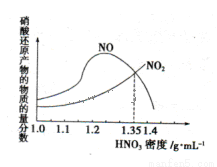
请写出铁与密度为1.35 g.m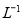 的硝酸反应的化学方程式:______________________.
的硝酸反应的化学方程式:______________________.
(2)亚硝酸钠是一种致癌物质,它在中性或碱性条件下是稳定的,酸化后能氧化碘化钾生成棕色溶液和NO,则该反应中氧化剂与还原剂的物质的量之比为____。
(3)如图甲为NO2和C0反应生成CO2和NO过程的能量变化示意图,请写出该反应的热化学方程式:__________________________________________________________.
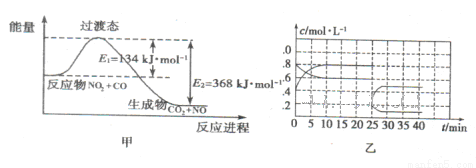
(4)已知NO2和N2O4可以相互转化:2NO2(g)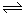 N2O4(g) △H<0。现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图乙所示。
N2O4(g) △H<0。现将一定量的NO2和N2O4混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物的浓度随时问变化关系如图乙所示。
①前10 min内用NO2表示的平均反应速率v(NO2)= ;上述反应的平衡常数K=__________。
②反应进行至25 min时,曲线发生变化的原因是________________________.
③若要使上述反应的平衡常数K增大,采取的措施是_________________。
A.加入催化剂B.缩小容器体积C.降低温度 D.再加入一定量的NO2
(14分)
(1)4Fe+18HNO3=4 Fe(NO3)3+3NO2↑+3NO↑+9H2O;(2分)
(2)1:1(2分)
(3)NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234kJ/mol(2分)
(4)①0.04 mol·L-1·min-1;(2分)0.9375;(2分)②增大容器体积;(2分)③C(2分)
【解析】
试题分析:(1)由图可知Fe与密度为1.35 g·mL-1的硝酸反应的气体产物是NO2、NO,且二者的物质的量相等,所以该反应的化学方程式为4Fe+18HNO3=4 Fe(NO3)3+3NO2↑+3NO↑+9H2O;
(2)亚硝酸钠酸化后能氧化碘,其中亚硝酸钠作氧化剂,碘化钾作还原剂,2NO2-~2NO,得2个电子,2I-~I2,失去2个电子,根据得失电子守恒规律,氧化剂与还原剂的物质的量之比为1:1;
(3)由图甲判断NO2和C0反应生成CO2和NO过程为放热反应,△H=E1-E2=-234kJ/mol,所以该反应的热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234kJ/mol;
(4)①根据乙图可知,浓度增大的曲线表示NO2,前10 min内NO2的浓度由0.4mol·L-1增大到0.8 mol·L-1,浓度的改变量是0.4 mol·L-1,所以前10 min内用NO2表示的平均反应速率
v(NO2)=0.4 mol·L-1/10min=0.04 mol·L-1·min-1;平衡时NO2和N2O4的浓度分别为0.8mol/L、0.6mol/L,所以K=0.6mol/L/0.82mol/L=0.9375;
②由图分析,NO2和N2O4的浓度都瞬间减小,若是温度的改变则其中一种物质的浓度肯定比原平衡时的浓度大,与图不符;若减小体积,则2种物质的浓度都要增大,所以只能是增大容器的体积,2种物质的浓度都减小;此题中不能答减小压强,因为压强的改变有多种途径,对物质浓度的影响也不一样;
③K是温度常数,只随温度变化,K=c(N2O4)/c2(NO2),所以要使K增大则需减小NO2的浓度增大N2O4的浓度,平衡正向移动,所以采取的措施只能是降低温度,答案选C。
考点:考查氧化还原反应的理论及应用,热化学方程式的书写,化学反应速率、化学平衡理论的应用


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
0.5体积某气态烃只能与0.5体积氯气发生加成反应,生成氯代烷。0.5mol此氯代烷可与4 mol氯气发生完全的取代反应,则该烃的结构筒式为
A.CH2==CH2 B.CH3CH==CH2
C.CH3CH3 D.CH3CH2CH==CH2
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河北区高三总复习质量检测一理综化学试卷(解析版) 题型:简答题
(20分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题:
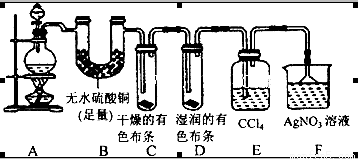
(1)下列方法中,可制得的正确组合是__________。
①MnO2和浓盐酸混合共热; ②MnO2、NaCl和浓硫酸混合共热:
③NaClO和浓盐酸混合; ④K2Cr2O7和浓盐酸混合:
⑤KClO3和浓盐酸混合共热; ⑥KMnO4和浓盐酸混合。
A.①②⑥B.②④⑥C.①④⑥ D.全部可以
(2)写出实验室制取Cl2的离子方程式____________。
(3)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制得Cl2的体积(标况下)总是小于1.12L的原因是_________________________________________。
(4)①装置B的作用是__________________________________。
②装置C和D出现的不同现象说明的问题是________________________。
③装置E的作用是_____________________。
(5)乙同学认为甲同学的实验有缺陷,不能确像最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置__________与________之间(填装置字母序号)增加一个装置,增加装置里面的试剂可为____________。
A.湿润的淀粉KI试纸B.氢氧化钠溶液
C.湿润的红色布条 D.饱和的食盐水
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河北区高三年级总复习质量检测三理综化学试卷(解析版) 题型:选择题
下列化学过程及其表述正确的是
A.向NaHSO4溶液中滴入Ba(OH)2溶液至中性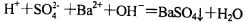
B.由水电离的c(H+)为l0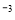 mol
mol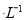 的溶液中,Na+、NO3-、SO32-、Cl-定能大量共存
的溶液中,Na+、NO3-、SO32-、Cl-定能大量共存
C.酸碱中和滴定时,盛装标准液的滴定管滴定前无气泡,终点读数时有气泡,导致计算结果偏低
D.可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性
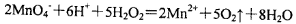
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河东区高三二模考试理综化学试卷(解析版) 题型:选择题
下列药品和装置合理且能完成相应实验的是
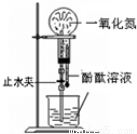
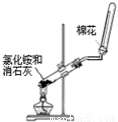
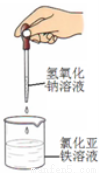
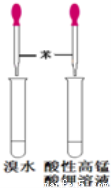
A B C D
A.喷泉实验 B.实验室制取并收集氨气
C.制备氢氧化亚铁 D.验证苯中是否含有碳碳双键
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河东区高三一模理综化学试卷(解析版) 题型:选择题
有0.1 mol 的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
A.溶液①中,C(CH3COO-)=C(H+)
B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的C(CH3COO-)
C.溶液①、②等体积混合,混合液中c(CH3COO-)+ c(CH3COOH)= C(Na+)
D.溶液①、③等体积混合,混合液中C(Na+)>C(CH3COO-)> C(H+)>C(OH-)
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高三第五次月考理综化学试卷(解析版) 题型:填空题
(18分)B是一种五元环状化合物,其核磁共振氢谱只有一个峰;H的核磁共振氢谱有3个峰,峰面积之比为2:2:1;I是一种合成橡胶和树脂的重要原料。已知R是烃基,有关物质转化关系及信息如下:
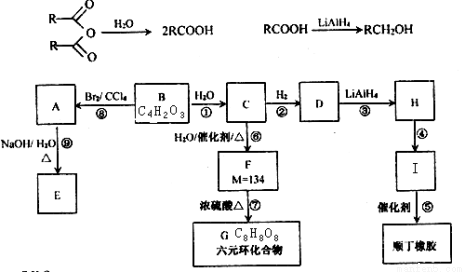
请按要求回答下列问题:
(1)A的不含氧官能团为 _______________;③反应类型为____________________。
(2)B的结构简式为 __________________;H按系统命名法应命名为________________。
(3)写出下列反应的化学方程式:
⑦ ____________________________________________________________________。
⑨ ____________________________________________________________________。
(4)写出顺丁橡胶的结构简式_____________________________。顺丁橡胶弹性高,耐寒性好,而有机硅橡胶既耐高温又耐低温,合成路线如下:
二氯硅烷(CH3)2SiCl2 二甲基硅二醇 (CH3)2Si(OH)2
二甲基硅二醇 (CH3)2Si(OH)2 硅橡胶
硅橡胶
请写出缩聚的化学方程式__________________________________________________________。
(5)有机物J与F互为同分异构体,且具有相同的官能团种类和数目,写出所有符合条件的J的结构简式(不包括F):_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市第二学期期中检测高一化学试卷(解析版) 题型:选择题
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是

A.非金属性:Z<T<X B.R与Q的电子数相差26
C.气态氢化物稳定性:R <T<Q D.最高价氧化物的水化物的酸性:T>Q
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市下学期期中考试高二化学试卷(解析版) 题型:选择题
下列醇中既能发生消去反应,又能被氧化为酮的是

A.①④⑤ B . ②④⑥  C . ② ⑥ D . ①②⑥
C . ② ⑥ D . ①②⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com