
| A、从海带中提取碘单质的过程不涉及氧化还原反应 |
| B、往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输 |
| C、赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的 |
| D、虽然海水中元素的种类很多,总储量很大,但许多元素的富集程度很低 |


科目:高中化学 来源: 题型:
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| NaOH |
| ② |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:1 | B、1:2 |
| C、3:2 | D、2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、聚乙烯塑料的老化是由于发生了加成反应 |
| B、合成纤维、人造纤维及碳纤维都属于有机高分子材料 |
C、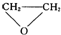 和CO2反应生成可降解聚合物[O-CHCH2-O-CO]n,该反应符合绿色化学的原则 和CO2反应生成可降解聚合物[O-CHCH2-O-CO]n,该反应符合绿色化学的原则 |
| D、煤经过气化和液化等物理变化可以转化为清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、197>Q1>Q2 |
| B、Q1>2Q3 |
| C、Q1=Q4 |
| D、Q3<Q4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
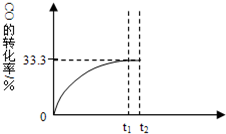 某温度下,向密闭容器中充入2.0mol CO和1.0mol H2O,发生反应:
某温度下,向密闭容器中充入2.0mol CO和1.0mol H2O,发生反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com