
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。

请到答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
【答案】(1)蒸馏烧瓶 Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O
(2)溶液由紫色变为无色 无色溶液中出现黄色浑浊 还原性 氧化性;
2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+
(3)品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,溶液恢复为红色
(4)NaOH
【解析】
试题分析:(1)装置A中盛放亚硫酸钠的仪器名称是蒸馏烧瓶;亚硫酸钠与浓硫酸反应反应生成硫酸钠、二氧化硫气体和水,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O。
(2)高锰酸钾溶液为紫红色,具有氧化性,二氧化硫具有还原性,二者发生氧化还原反应,则观察到红色逐渐变浅直至完全褪去,二氧化硫进入硫化钠溶液中发生的氧化还原反应为2S2-+SO2+2H2O=3S↓+4OH-,则观察到出现黄色浑浊;B中S元素的化合价升高,表现还原性,C中二氧化硫中硫元素的化合价降低,表现氧化性;高锰酸钾溶液和二氧化硫气体发生的离子反应为:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+。
(3)因二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色,则操作为待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,观察到的现象为无色溶液恢复为红色。
(4)尾气中含有SO2,为酸性氧化物,能与碱反应生成盐和水,所以利用氢氧化钠溶液来吸收尾气。


科目:高中化学 来源: 题型:
【题目】下面是一些原子的电子排布,其中不是激发态原子的是( )
A. 1s22s22p6B. 1s22s13s1C. 1s22s24d1 D. 1s22s22p23s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、
CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
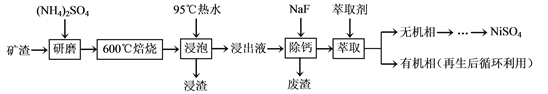
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成
NiSO4、Fe2(SO4)3。
锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是___________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为____________________。
“浸渣”的成分除Fe2O3、FeO(OH)外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的_______倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为___________________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
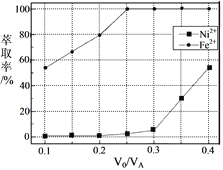
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某氨基酸(CxHyNzOp)的分子组成。取m g 该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。按下图所示装置进行实验。

请回答下列问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是__________________
(2)以上装置中需要加热的仪器有_________________(用字母填空,下同)。操作时应先点燃_______处的酒精灯。
(3)A装置中发生反应的化学方程式是_____________________。
(4)装置D的作用是___________________________。
(5)读取N2的体积时,应注意
①______________________
②______________________
③______________________
(6)实验中测得N2的体积为V mL(标准状况)。为确定此氨基酸的化学式,还需要的有关数据是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是世界上年产量超过100万吨的高分子单体,旧法合成的反应是
(CH3)2C==O+HCN→ (CH3)2C(OH)CN
(CH3)2C(OH)CN+CH3OH+H2SO4→CH2== C(CH3)COOCH3+NH4HSO4,
90年代新的反应是:CH3C≡CH+CO+CH3OH![]() CH2==C(CH3)COOCH3,与旧法比较,新法的优点是:①原料无爆炸危险 ;②原料都是无毒物质;③没有副产物,原料利用率高;④对设备腐蚀性较小。正确的是
CH2==C(CH3)COOCH3,与旧法比较,新法的优点是:①原料无爆炸危险 ;②原料都是无毒物质;③没有副产物,原料利用率高;④对设备腐蚀性较小。正确的是
A. ①② B. ③④ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少大气污染,许多城市推广汽车使用清洁燃料。目前使用的清洁燃料主要有两类,一类是压缩天然气(CNG),另一类是液化石油气(LPG)。这两类燃料的主要成分都是( )。
A.碳水化合物B.碳氢化合物C.氢气D.醇类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用系统命名法命名的有机物名称正确的是( )
A. 2 -甲基-4 -乙基戊烷B. 3, 4, 4 -三甲基己烷
C. 2, 3 -二乙基-1 -戊烯D. 1, 2, 4 -三甲基-1 -丁醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com