
【题目】下列分散系能产生丁达尔效应的是
A. 食盐水 B. 稀硫酸 C. 氢氧化钠溶液 D. 稀豆浆
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R、T是前四周期原子序数依次增大的六种元素,其中X元素形成的气体单质密度最小,Y元素氢化物的水溶液呈碱性,Z、R元素最外层电子数相同且Z的原子序数为R的一半,Q的原子半径在第三周期中最大,T是目前应用最广泛的金属。回答下列问题:
(1)T在周期表中的位置是___________________,其M层上的电子排布式为_______________。
(2)Y、Z、R的第一电离能由大到小的顺序为_________________(用元素符号表示)。
(3)根据等电子体原理,Y2Z分子的结构式为________________。
(4)YZ能被TRZ4溶液吸收生成配合物[T(YZ)(X2Z)5]RZ4,该配合物中含有的化学键类型有_______,RZ42-离子中R原子的杂化方式为_____________________。
(5)由Q与Z、R可形成多种化合物,写出Q2Z2的电子式:____________,
Q2Z熔点比Q2R高,其原因是________________________________________。
(6)QX晶体的结构与NaCl相同,若Q+与最邻近X-的核间距离为a pm,阿伏加德罗常数为NA,则QX晶体的密度为______________________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置图(有些图中部分夹持仪器未画出)不能达到其实验目的的是
|
|
A.证明酸性:盐酸>碳酸>苯酚 | B.实验室制取乙酸乙酯 |
|
|
C.石油分馏 | D.实验室制取硝基苯 |
A.A B.B C.C D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离或提纯物质的方法正确的是
A. 用蒸馏的方法分离水和油的混合物
B. 用分液的方法分离酒精和水的混合物
C. 用过滤的方法除去NaCl溶液中含有的少量泥沙
D. 用加热、蒸发的方法可以除去NaCl中CaCl2、MgCl2等杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是三种难溶金属硫化物的溶度积常数(25 ℃):下列有关说法中正确的是
化学式 | FeS | CuS | MnS |
溶度积 | 6.3×10-18 | 1.3×10-36 | 2.5×10-13 |
A. 25 ℃时,将CuS固体用含Mn2+的饱和溶液浸泡可溶解CuS固体
B. 25 ℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol·L-1
C. 除去某溶液中的Cu2+,可以选用FeS作沉淀剂
D. 因为H2SO4是强酸,所以反应CuSO4+H2S===CuS↓+H2SO4不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式硫酸铁[Fe(OH)SO4]可用做净水剂、媒染剂等。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的部分工艺如下:
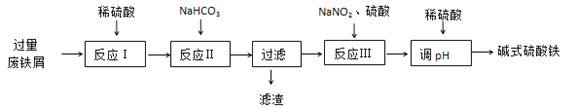
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)反应Ⅰ中氧化还原反应的离子方程式__________________ 、 ___________________。
(2)反应Ⅱ中加入NaHCO3调节体系的pH在_____________范围内。
(3)反应Ⅲ中生成的气体遇空气变红棕色,该反应的离子方程式是_____________________。
(4)若反应Ⅲ中通入O2可减少NaNO2的用量,当消耗1molO2可节约n(NaNO2)=_____mol。
(5)用稀硫酸调节体系的pH时,若硫酸加入量过少,容易生成沉淀;若硫酸加入量过大,不利于产品形成,用化学平衡移动原理说明其原因______________________________。
(6)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.分子晶体和离子晶体中一定都含有化学键
B.金属晶体中,原子半径越大,金属键越强
C.同一个原子中的p轨道形状完全相同
D.焰色反应与电子跃迁有关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com