
【题目】关于下列图示的说法中正确的是( )
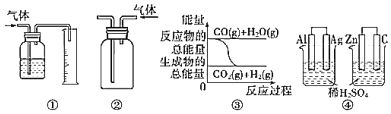
A.用图①所示装置测量气体的体积
B.用图②所示实验装置排空气法收集CO2气体
C.图③表示可逆反应CO(g)+H2O(g)![]() CO2(g)+H2(g)是放热反应
CO2(g)+H2(g)是放热反应
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
【答案】C
【解析】
A. 量气时导气管应该遵循“短进长出”原则,否则左侧广口瓶中水无法排出到量筒中,A错误;
B. 二氧化碳密度大于空气,应该采用向上排空法收集二氧化碳,所以集气瓶中导气管采用“长进短出”原则,B错误;
C. 反应物总能量小于生成物总能量,则该反应为吸热反应,否则为放热反应,由图可知,反应物总能量大于生成物总能量,所以CO(g)+H2O(g)![]() CO2(g)+H2(g)为放热反应,C正确;
CO2(g)+H2(g)为放热反应,C正确;
D. 左侧Al作负极、右侧Zn作负极,每个Al原子失去3个电子生成Al3+、每个Zn原子失去2个电子生成Zn2+,所以④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量:Al<Zn,D错误;
故答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关于烃的说法错误的是( )

A.该烃分子中共面的碳原子最多为 14 个
B.该烃分子中共直线的碳原子最多为 6 个
C.该烃存在顺反异构
D.该物质可以发生氧化反应、取代反应、加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素a、b、c、d、e,其原子半径与原子序数的关系如图,下列说法错误的是
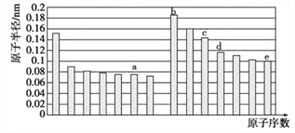
A. c元素的离子半径比e的离子半径小
B. d元素对应的最高价氧化物的水化物酸性比e元素弱
C. b、c、d三种元素对应的最高价氧化物的水化物相互间能发生反应
D. a与b两种元素可形成既有离子键又有非极性共价键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿“烧渣”(主要成分Fe3O4,Fe2O3,FeO和部分难溶于酸的杂质)制备绿矾(FeSO47H2O)的流程如下:

已知:FeS2(S的化合价为-1)难溶于水。
(1)①中加入的酸为____________(填名称)。
(2)①中生成Fe3+的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O、____________。
(3)检验②中Fe3+已经完全转化为Fe2+实验方法:取适量溶液2,____________。
(4)通过③得到绿矾晶体的实验操作:加热浓缩、冷却结晶、____________、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到目的是
A.用萃取的方法分离煤油和汽油
B.用水鉴别苯、四氯化碳、乙醇三种无色液体
C.用如图装置验证Na和水反应是否为放热反应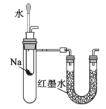
D.棉织品与丝织品可以用灼烧法进行鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液,量取10.00mL食用白醋,注入烧杯中用水稀释后转移到_____(填仪器名称)中定容,摇匀即得;
(2)取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴_____作指示剂;
(3)读取盛装0.1000mol/L NaOH溶液的______(填仪器名称)的初始读数,如果液面位置如下图所示,则此时的读数为______mL。
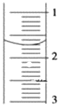
(4)滴定,当__________时,停止滴定,并记录NaOH溶液的终读数,重复滴定3次。
Ⅱ.实验记录
1 | 2 | 3 | 4 | |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(5)经计算,市售白醋总酸量=_______g/100mL (醋酸的式量=60)。
(6)在本实验过程中,下列操作会使实验结果偏大的是______(填写序号)
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管在尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定剧烈摇动,有少量液体溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用黄铜矿(主要成分是CuFeS2)生产粗铜的反应原理如下:

(1)已知在反应①、②中均生成相同的气体分子,该气体具有漂白性。请分别写出反应①、②的化学方程式是___________________、__________________。
(2)基态铜原子的核外电子排布式为________,硫、氧元素相比,第一电离能较大的是________。
(3)反应①和②生成的气体分子的中心原子的杂化类型是________,分子的空间构型是________。
(4)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的恒容密闭容器中,X、Y、Z三种无色气体的物质的量随时间的变化曲线如图所示。
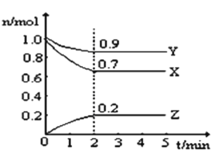
(1)起始时X的浓度为c(X)=_______;反应从开始至2分钟末,Y的转化率为α(Y)=________;用Z的浓度变化表示0-2分钟内的平均反应速率为v(Z)=___________。
(2)由图中所给数据进行分析,该反应的化学方程式为___________。
(3)能说明该反应已达到平衡状态的是___________
A.![]() (X)=3
(X)=3![]() (Y)
(Y)
B.容器内气体密度不变
C.2![]() 逆(X)=3
逆(X)=3![]() 正(Z)
正(Z)
D.各组分的物质的量相等
E.混合气体的平均相对分子质量不再改变的状态
F.容器内气体颜色不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低浓度的氢氟酸是一元弱酸,存在下列两个平衡:HF![]() H++F-,HF+F-
H++F-,HF+F-![]() HF2- (较稳定)。25℃时,不同酸性条件下的2.0amol·L-1HF溶液中,c(HF)、c(F-)与溶液pH(忽略体积变化)的变化关系如图所示。下列说法正确的是( )
HF2- (较稳定)。25℃时,不同酸性条件下的2.0amol·L-1HF溶液中,c(HF)、c(F-)与溶液pH(忽略体积变化)的变化关系如图所示。下列说法正确的是( )
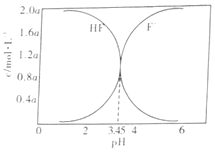
A.c(HF)+c(F-)=2.0amol·L-1
B.c(F-)>c(HF)时,溶液一定呈碱性
C.随着溶液pH增大,![]() 不断增大
不断增大
D.25℃时,HF的电离常数Ka=10-3.45
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com