
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
分析 (1)根据溶液中电荷守恒计算H+离子浓度和pH值;
(2)①盖斯定律的内容为:化学反应的反应热值与反应的始态和终态有关,而与反应进行的途径无关;根据盖斯定律,用第一个热化学方程式减去第二个热化学方程式可得焦炭与水蒸气反应的热化学方程式;
②二氧化硫是一种酸性氧化物可以和碱反应,二氧化硫溶于水得亚硫酸,酸性强于碳酸,所以可以和碳酸钠溶液反应;
解答 解:(1)溶液中电荷守恒:C(K+)+C(NH4+)+c(Na+)+C(H+)=2C(SO42-)+C(NO3-)+C(Cl-),4×10-6mol/L+2×10-5mol/L+6×10-6mol/L+C(H+)=2×4×10-5mol/L+3×10-5mol/L+2×10-5mol/L,得C(H+)=1×10-4mol•L-1,pH=-lg[H+]=4,溶液显酸性;
故答案为:酸性;4;
(2)①已知:①H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.81kJ•mol-1,②C(s)+$\frac{1}{2}$O2(g)═CO(g);△H=-110.51kJ•mol-1,
利用盖斯定律,将②-①可得:C(s)+H2O(g)=CO(g)+H2(g),△H=(-110.5kJ/mol)-(-241.8kJ/mol)=+13l.3 kJ/mol,
所以焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g);△H=+13l.30kJ•mol-1,
故答案为:C(s)+H2O(g)═CO(g)+H2(g);△H=+13l.30kJ•mol-1;
②a.二氧化硫是酸性氧化物所以具有酸性氧化物的通性能够与碱反应:SO2+Ca(OH)2=CaSO3↓+H2O,可以用氢氧化钙吸收二氧化硫,故a正确;
b.二氧化硫水溶液是亚硫酸所以也能够与碳酸钠反应:SO2+Na2CO3=Na2SO3+CO2↑,可以用碳酸钠溶液做洗涤剂,故b正确;
c.二氧化硫与氯化钙溶液不反应,不能用氯化钙溶液吸收二氧化硫,故c错误;
d.二氧化硫与硫氢化钠溶液反应生成硫单质,所以可以用硫氢化钠溶液吸收,故d正确;
故选:abd;
点评 本题为综合题,考查了离子浓度、溶液pH值的计算,热化学方程式的书写,物质的性质等,掌握盖斯定律的含义,明确溶液中电荷守恒规律及pH计算公式是解题关键,题目难度中等.


 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:选择题
| t/s | 0 | 500 | 1000 |
| C(H2O)/mol•L-1 | 5.00 | 3.52 | 2.48 |
| C(CO2)/mol•L-1 | 2.50 |
| A. | 在500s内用H2O(g)表示的化学反应速率是2.96×10-3mol•L-1•s-1 | |
| B. | 在500s时生成的CH4的浓度是0.74mol•L-1 | |
| C. | 在1000s时反应达到平衡 | |
| D. | 0-500s的平均反应速率大于500~1000s的平均反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
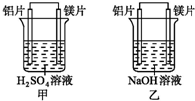 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1 H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1 H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ③元素形成的单质晶体均属于原子晶体 | |
| B. | ②、⑦、⑧对应的简单离子半径依次减小 | |
| C. | ②⑤形成的化合物阴阳离子个数比可能为1:1 | |
| D. | ④元素的气态氢化物易液化,是因为其分子间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素的最简单气态氢化物中W的沸点最高 | |
| B. | W、X、Y、Z的简单阴离子都会促进水的电离 | |
| C. | 原子的半径:Y>Z>W>X | |
| D. | YX2、YX3通入BaCl2溶液中均有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
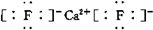 ;若 XY2其结构式为:S=C=S.为共价化合物时,
;若 XY2其结构式为:S=C=S.为共价化合物时,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
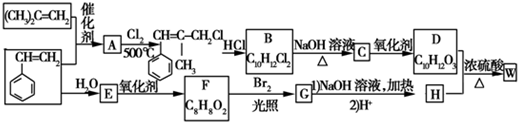
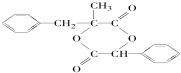 .
.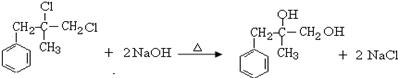 ;由D生成高分子化合物的方程式为
;由D生成高分子化合物的方程式为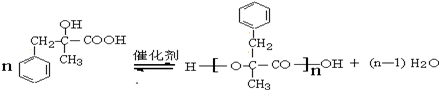 .
.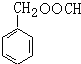 (写结构简式),其峰面积之比为1:2:2:2:1.
(写结构简式),其峰面积之比为1:2:2:2:1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com