
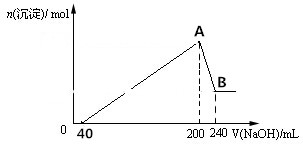
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2molNH3 |
| 达到平衡的时间/min | 5 | 8 | |
| 平衡时N2的浓度/mol•L-1 | c1 | 1.5 | |
| NH3的体积分数 | W1 | W3 | |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 容器乙中反应从开始到达平衡的反应速率为v(H2)=1.5mol•L-1•min-1 | |
| B. | 2c1<1.5 | |
| C. | 2ρ1=ρ2 | |
| D. | 在该温度下甲容器中反应的平衡常数K=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}(3{c}_{1}-1.5)^{3}}$ |
分析 A、先计算氮气的反应速率,再根据同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比计算氢气反应速率;
B、先将丙中的数据按照化学计量数转化成反应物氮气、氢气的物质的量,然后利用等效平衡知识进行分析;
C、反应前后都是气体,容器的容积都是2L,乙中混合气体的质量为甲的2倍,根据ρ=$\frac{m}{V}$分析;
D、甲容器中,反应前氢气浓度为c(H2)=$\frac{3}{2}$mol/L=1.5mol/L,氮气的浓度为$\frac{2}{2}$mol/L=1mol/L,达到平衡时氮气的浓度变化为(1-c1)mol/L,
由化学平衡的三段式可得:
3H2(g)+N2(g)?2NH3(g)
反应前(mol/L):1.5 1 0
浓度变化:(mol/L):3(1-c1) (1-c1) 2(1-c1)
反应后:(mol/L):1.5-3(1-c1) 1-(1-c1) 2(1-c1)
化学平衡常数K=$\frac{[N{H}_{3}]^{2}}{[{N}_{2}][{H}_{2}]^{3}}$;
解答 解:A、氮气的反应速率=$\frac{\frac{4mol}{2L}-1.5mol/L}{5min}$=0.1mol/(L.min),同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比,所以氢气反应速率=0.3mol/(L.min),故A错误;
B、恒温、恒容条件下,假设乙容器的容积为4L,则达到平衡时甲乙为等效平衡,各组分的含量、浓度相等,此时氮气的浓度为c1,然后将容器的容积缩小到2L,若平衡不移动,2c1=1.5mol/L,由于压强增大,平衡向着正向移动,氨气的浓度增大,所以2c1>1.5mol/L,故B错误;
C、反应前后都是气体,容器的容积都是2L,乙中混合气体的质量为甲的2倍,根据ρ=$\frac{m}{V}$可知:2ρ1=ρ2,故C正确;
D.甲容器中,反应前氢气浓度为c(H2)=$\frac{3}{2}$mol/L=1.5mol/L,氮气的浓度为$\frac{2}{2}$mol/L=1mol/L,达到平衡时氮气的浓度变化为(1-c1)mol/L,
由化学平衡的三段式可得:
3H2(g)+N2(g)?2NH3(g)
反应前(mol/L):1.5 1 0
浓度变化:(mol/L):3(1-c1) (1-c1) 2(1-c1)
反应后:(mol/L):1.5-3(1-c1) c1 2(1-c1)
化学平衡常数K=$\frac{[N{H}_{3}]^{2}}{[{N}_{2}][{H}_{2}]^{3}}$=$\frac{[2(1-{c}_{1})]^{2}}{{c}_{1}×[1.5-3(1-{c}_{1})]^{3}}$=$\frac{(2-2{c}_{1})^{2}}{{c}_{1}×(3{c}_{1}-1.5)^{3}}$,故D正确;
故选CD.
点评 本题以化学平衡移动原理为载体考查平衡状态判断、等效平衡、化学平衡计算等知识点,侧重考查基本理论,难点构建等效平衡,然后利用外界条件对平衡的影响分析解答,题目难度中等.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
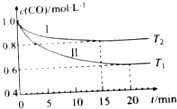 为了减少CO对大气的污染,某科研小组在一个体积为1L的容积不变的密闭容器中充入等量的CO和H2O(g),研究用CO和H2O(g)反应转化为绿色能源H2,不同温度下,CO的浓度[c(CO)]随时间[t]变化的曲线如图所示.
为了减少CO对大气的污染,某科研小组在一个体积为1L的容积不变的密闭容器中充入等量的CO和H2O(g),研究用CO和H2O(g)反应转化为绿色能源H2,不同温度下,CO的浓度[c(CO)]随时间[t]变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
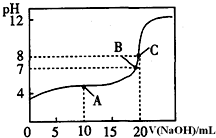 (1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”),原因是醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”);
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”),原因是醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 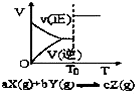 密闭容器中反应达到平衡,T0时改变某一条件有如图变化所示,则改变的条件一定是加入催化剂 | |
| B. | 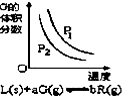 反应达到平衡时,外界条件对平衡影响关系如图所示,则正反应为放热反应,且a>b | |
| C. | 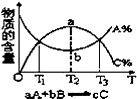 物质的百分含量和温度关系如图所示,则该反应的正反应为吸热反应 | |
| D. | 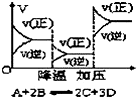 反应速率和反应条件变化关系如图所示,则该反应的正反应为放热反应,A、B、C是气体、D为固体或液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | 过量Ba(OH)2溶液与少量的NaHCO3溶液混合Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| C. | 石英溶于NaOH溶液:Si4++2O2-+2OH-=SiO32-+H2O | |
| D. | 硅酸钠溶液中滴加盐酸:SiO32-+2H+═H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②⑤⑥ | C. | ③④ | D. | 只有⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )| A. | 为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 | |
| B. | 甲装置中阴极的反应为Fe-2e-═Fe2+ | |
| C. | 为了增加污水的导电能力,应向污水中如入适量的NaOH溶液 | |
| D. | 当乙装置中有1.6 g CH4参加反应,则C电极理论上生成气体在标准状况下为4.48 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com