
| A. | 放电时,Li+在电解质中由负极向正极迁移 | |
| B. | 放电时,负极的电极反应式为LixC6-xe-═xLi++C6 | |
| C. | 充电时,若转移1mol e-,石墨(C6)电极将增重7x g | |
| D. | 充电时,阳极的电极反应式为LiCoO2-xe-═Li1-xCoO2+xLi+ |
分析 放电时的反应为Li1-xCoO2+LixC6═LiCoO2+C6,Co元素的化合价降低,Co得到电子,则Li1-xCoO2为正极,LixC6为负极,Li元素的化合价升高变成Li+,结合原电池中负极发生氧化反应,正极发生还原反应,充电是放电的逆过程,据此解答.
解答 解:放电时的反应为Li1-xCoO2+LixC6═LiCoO2+C6,Co元素的化合价降低,Co得到电子,则Li1-xCoO2为正极,LixC6为负极,Li元素的化合价升高变成Li+,结合原电池中负极发生氧化反应,正极发生还原反应,充电是放电的逆过程,
A.放电时,负极LixC6失去电子得到Li+,在原电池中,阳离子移向正极,则Li+在电解质中由负极向正极迁移,故A正确;
B.放电时,负极LixC6失去电子产生Li+,电极反应式为LixC6-xe-═xLi++C6,故B正确;
C.充电时,石墨(C6)电极变成LixC6,电极反应式为:xLi++C6+xe-═LixC6,则石墨(C6)电极增重的质量就是锂离子的质量,根据关系式:
xLi+~~~xe-
1mol 1mol
可知若转移1mole-,就增重1molLi+,即7g,故C错误;
D.正极上Co元素化合价降低,放电时,电池的正极反应为:Li1-xCoO2+xLi++xe-═LiCoO2,充电是放电的逆反应,故D正确;
故选:C.
点评 本题考查二次电池的充放电原理,明确电池反应中元素的化合价变化及原电池的工作原理即可解答,注意与氧化还原反应的结合,在写电极反应式时注意装置中有自由移动的Li+,C选项考查学生的仔细程度,难度适中.


科目:高中化学 来源: 题型:解答题
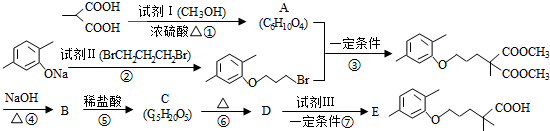
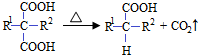 (R1和R2代表烷基)
(R1和R2代表烷基)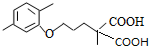 $\stackrel{加热}{→}$
$\stackrel{加热}{→}$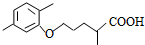 +CO2↑.
+CO2↑.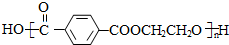 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径:Na+>Al3+>S2->Cl- | B. | 沸点:F2<Cl2<Br2<I2 | ||
| C. | 碱性:LiOH<NaOH<KOH<RbOH | D. | 熔点:Li>Na>K>Rb |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

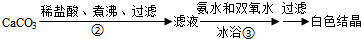
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
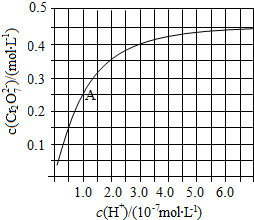 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②为放热反应 | |
| C. | 反应③使用催化剂,△H3减小 | |
| D. | 反应CH4(g)═C(s)+2 H2(g)的△H=74.8kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com