
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA
B.l mol Fe(NO3)3与足量HI溶液反应时转移的电子数为3NA
C.1 mol Na2O2固体中含离子总数为4NA
D.常温下,1 mol Fe与过量浓HNO3反应,转移电子的数目为3 NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014-2015学年湖南省益阳市高三四月调研考试理综化学试卷(解析版) 题型:简答题
(16分)二氧化硫常用作消毒剂和漂白剂,也是一种重要的工业原料。
(1)将a mol SO2通入1 L 1 mol/L NaOH溶液中充分反应后,阴离子总数 阳离子总数(填选项前的字母)。
A.a>1时大于 B.a=1时等于 C.大于 D.小于
(2)保险粉(Na2S2O4)广泛用于印染行业和食品储存行业。可以将SO2通入草酸钠(Na2C2O4)和NaOH的混合溶液中制取保险粉。制取保险粉的离子方程式为 。
(3)工业上常以SO2为原料制取Na2S2O3。步骤如下:
①将Na2S和Na2CO3按2︰1的物质的量之比配成混合溶液。
②将混合溶液注入敞口反应釜中,加热反应釜将温度控制在50℃左右。
③向反应釜中缓缓通入SO2至稍微过量使Na2S和Na2CO3完全反应。
④反应结束后加热浓缩溶液,冷却至30℃以下析出大量Na2S2O3晶体。
⑤滤出晶体,母液循环利用。
据此请回答:
(ⅰ)工业制取Na2S2O3的反应的化学方程式为 。
(ⅱ)工业生产的首要目的是盈利,为节约成本并减少对环境的污染,应尽可能的提高产率,制取步骤中体现了这一思想的有 (填步骤序号)。
(ⅲ)工业生产的Na2S2O3含有两种杂质,这两种杂质是Na2SO3和 。以下条件中可以求出产品中Na2S2O3的物质的量分数的是 。(填选项前的字母)
A.产品中钠原子和硫原子的物质的量之比
B.产品中钠原子和氧原子的物质的量之比
C.产品中硫原子和氧原子的物质的量之比
D.以上均能
(4)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
每吸收标准状况下11.2 L SO2,被SO2还原的O2的质量为 g。
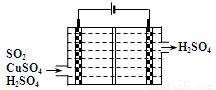
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市七校高三4月联考化学试卷(解析版) 题型:选择题
室温下,下列溶液中粒子浓度大小关系正确的是
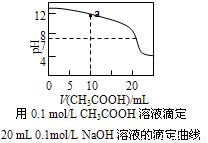
A.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
B.pH相同的①CH3COONa②NaHCO3③NaAlO2三份溶液中的c(Na+):②>③>①
C.0.1molL-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
D.上图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市和平区高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应: 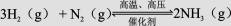 。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
。按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物的投入量 | 3 molH2、2 molN2 | 6 molH2、4 molN2 | 2 molNH3 |
达到平衡的时间/min | 5 | 8 | |
平衡时N2的浓度/ mol·L-1 | c1 | 1.5 | |
NH3的体积分数 | φ1 | φ2 | |
混合气体的密度/g·L-1 | ρ1 | ρ2 |
下列说法不正确的是
A.容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol·L-1·min-1
B.在该温度下甲容器中反应的平衡常数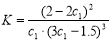
C.2c1<1.5
D.2ρ1=ρ2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三下学期第二次月考化学试卷(解析版) 题型:简答题
液晶高分子材料应用广泛。新型液晶基元——化合物Ⅳ的合成线路如下:
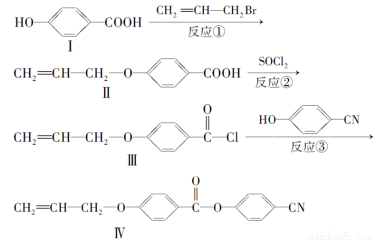
(1)化合物Ⅰ的分子式为________,1 mol化合物Ⅰ最多可与________mol NaOH反应。
(2)CH2=CH—CH2Br与NaOH水溶液反应的化学方程式为(注明条件)______________。
(3)化合物Ⅰ的同分异构体中,苯环上一溴代物只有2种且能发生银镜反应的化合物有多种,写出其中一种同分异体的结构简式____________________。
(4)下列关于化合物Ⅱ的说法正确的是_______(填字母)。
A.属于烯烃 B.能与FeCl3溶液反应显紫色
C.一定条件下能发生加聚反应 D.能使溴的四氯化碳溶液褪色
(5)反应③的反应类型是________。在一定条件下,化合物 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是__________。
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ。Ⅴ的结构简式是__________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:简答题
钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下:
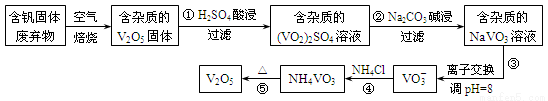
部分含钒化合物在水中的溶解性如下表:
物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
部分含钒化合物在水中的溶解性如下表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有___________。
(2)反应②碱浸后滤出的固体主要成分是 (写化学式)。
(3)反应④的离子方程式为 。
(4)25℃、101 kPa时,4Al(s)+3O2(g)==2Al2O3(s) ΔH1=-a kJ/mol
4V(s)+5O2(g)==2V2O5(s) ΔH2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是 。
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为 ,电池充电时阳极的电极反应式是 。

(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO2++H2C2O4+2H+===2VO2++2CO2↑+2H2O。取25.00 mL 0.1000 mol/L H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(VO2)2SO4溶液中钒的含量为 g/L。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法不正确的是
A.46 g C2H6O中含有的C-H键数一定为5NA
B.常温常压下,17 g甲基(-14CH3)所含电子总数为9NA
C.标准状况下,11.2 L CO2和乙炔的混合气体所含π键数目为NA
D.CO2气体与足量的Na2O2反应,固体增重28 g时转移了NA个电子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闵行区高三下学期质量调研考试(二模)化学试卷(解析版) 题型:推断题
(本题共8分)有机物聚合物M: 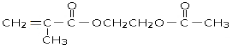 是锂电池正负极之间锂离子迁移的介质。由烃C4H8合成M的合成路线如下:
是锂电池正负极之间锂离子迁移的介质。由烃C4H8合成M的合成路线如下:

回答下列问题:
1.C4H8的结构简式为_________________,试剂II是________________。
2.检验B反应生成了C的方法是___________________________________________。
3.D在一定条件下能发生缩聚反应生成高分子化合物,反应的化学方程式为___________;
4.反应步骤③④⑤不可以为⑤③④的主要理由是_______________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省景德镇市高三下学期第三次质检考试理综化学试卷(解析版) 题型:简答题
【化学——选修3:物质结构与性质】(15分)卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的______区;溴的价电子排布式为________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_______(写出名称)。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:
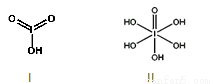
请比较二者酸性强弱:HIO3_____H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(6)下图为碘晶体晶胞结构。有关说法中正确的是_________。
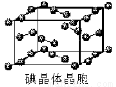
A.用均摊法可知平均每个晶胞中有4个碘原子
B.碘晶体为无限延伸的空间结构,是原子晶体
C.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(如图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
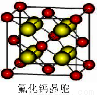
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com