
| A. | Cl2作氧化剂,发生还原反应 | |
| B. | 钾元素化合价降低 | |
| C. | 该反应是置换反应 | |
| D. | 每生成2 mol K2FeO4,转移3 mol电子 |
分析 2Fe(OH)3+3Cl2+10KOH$\frac{\underline{\;0-20℃\;}}{\;}$2K2FeO4+6KCl+8H2O反应中,Cl元素的化合价从0价降低到-1价,Cl2得电子作氧化剂,Fe元素的化合价从+3价升高到+6价,Fe(OH)3失电子作还原剂,据此分析.
解答 解:A.反应中,Cl元素的化合价从0价降低到-1价,Cl2得电子作氧化剂,发生还原反应,故A正确;
B.反应中钾元素的化合价不变,故B错误;
C.一种单质与一种化合物反应生成另一种单质和另一种化合物的反应为置换反应,该反应不是置换反应,故C错误;
D.Fe元素的化合价从+3价升高到+6价,每生成1 mol K2FeO4,转移3 mol电子,故D错误.
故选A.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | 分子式为C7H6O5 | |
| B. | 和溴水既可以发生取代反应,又可以发生加成反应 | |
| C. | 1 mol该化合物最多可以与含4 mol NaOH的溶液反应 | |
| D. | 既可以和FeCl3溶液发生显色反应,又可以和NaHCO3溶液反应放出CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
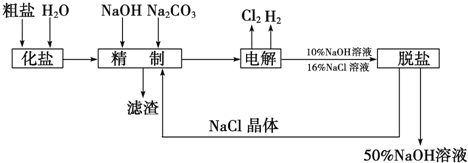
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol 甲基(-CH3)中含有的电子总数为NA | |
| B. | 标准状况下,11.2 L乙醇所含碳原子数目为NA | |
| C. | 常温常压下,26 g 苯中所含的碳碳双键数为NA | |
| D. | 23g钠在足量氧气充分燃烧,转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
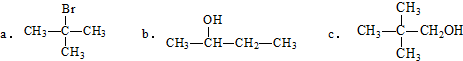
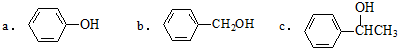
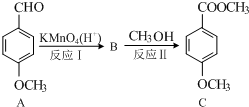
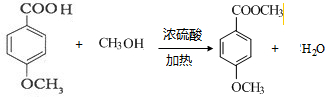 .
.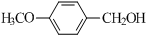 与O2反应制得,写出该反应的化学方程式
与O2反应制得,写出该反应的化学方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C30H50 | B. | C30H52 | C. | C30H56 | D. | C30H60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2一甲基一2一丁烯 | B. | 3,3一二甲基一2一丁醇 | ||
| C. | 4一甲基苯酚 | D. | 2,3,4一三甲基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
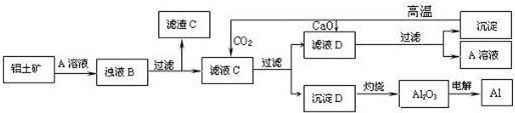
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com