
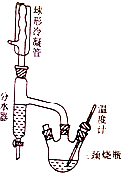
 实验室制备正丁醚的原理如下:
实验室制备正丁醚的原理如下:| 物质 | 密度/g•mL-1 | 熔点/℃ | 沸点/℃ | 水溶性 |
| 正丁醇 | 0.81 | -89.8 | 117.7 | 微溶于水 |
| 正丁醚 | 0.769 | -98 | 142 | 不溶于水 |
分析 (1)温度高于135℃时,正丁醇能发生消去反应得1-丁烯;
(2)水浴温度不超过100℃,油浴温度可达200℃左右,而砂浴温度更高;
(3)为提纯粗产品,应先用碳酸氢钠溶液去除反应的催化剂硫酸,再用水洗除去可溶于水的杂质,再干燥除去水分,水洗的操作为分液,使用分液漏斗时必需检漏;
(4)生成正丁醚时会有水产生,要分水器中可看到下面的水面会上升,据此判断;
(5)产率=$\frac{实际产量}{理论产量}$×100%,据此答题.
解答 解(1)温度高于135℃时,正丁醇能发生消去反应得1-丁烯,反应的方程式为CH3CH2CH2CH2OH$→_{高于135℃}^{浓H_{2}SO_{4}}$CH3CH2CH=CH2↑+H2O,
故答案为:CH3CH2CH2CH2OH$→_{高于135℃}^{浓H_{2}SO_{4}}$CH3CH2CH=CH2↑+H2O;
(2)水浴温度不超过100℃,油浴温度可达200℃左右,而砂浴温度更高,所以为控制温度在134-135℃,用油浴,
故选③;
(3)为提纯粗产品,应先用碳酸氢钠溶液去除反应的催化剂硫酸,再用水洗除去可溶于水的杂质,再干燥除去水分,所以操作顺序为③②①,水洗的操作为分液,主要玻璃仪器名称为分液漏斗,使用分液漏斗时必需检漏,
故答案为:③②①;去除反应的催化剂硫酸;分液漏斗;检漏;
(4)生成正丁醚时会有水产生,要分水器中可看到下面的水面会上升,当分水器中液面不再上升时,反应基本进行完全,
故答案为:分水器中液面不再上升;
(5)由2CH3CH2CH2CH2OH$→_{135℃}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O,
74×2 130
36.5×0.81 g mg
则m=$\frac{36.5×0.81g×130}{74×2}$=26.0g
产率=$\frac{实际产量}{理论产量}$×100%=$\frac{13.0g}{26.0g}$×100%=50.0%,
故答案为:50.0%.
点评 本题考查有机化学实验、反应原理、基本操作、化学计算等,题目难度中等,注意把握常见实验操作、尾气处理、仪器使用,注意对基础知识的理解掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | 其他不溶于酸的物质 |
| 质量分数(%) | 65~66 | 3.5~5.0 | 1.5~3.5 | 0.2~0.8 | 0.2~1.1 | 1.0~1.8 | 23-26 |

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
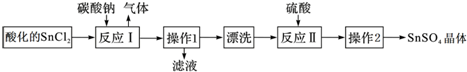
| A. | SnCl2酸化是为了防止溶解时发生水解 | |
| B. | 反应I中发生的离子反应为:CO32-+2H+=CO2↑+H2O | |
| C. | 漂洗时,将固体置于烧杯中,加蒸馏水洗涤过滤2~3次 | |
| D. | 操作1为过滤,操作2为结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)3CCH2CH3 | B. | (CH3CH2)2CHCH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)2CHCH2CH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径A<B<C | |
| B. | A的氢化物的稳定性大于C的氢化物 | |
| C. | A的氧化物是离子化合物,B的氧化物是共价化合物 | |
| D. | A与C可形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛﹑甲酸甲酯 | B. | 丙烯﹑环丙烷 | C. | 乙酸﹑甲酸甲酯 | D. | 乙烯﹑1-丁烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com