
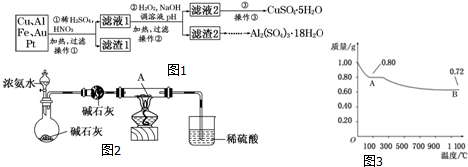
分析 制备硫酸铜和硫酸铝晶体的流程:Cu、Al、Fe及少量Au、Pt等金属的混合物和稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应Cu+4H++2NO3-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++2NO2↑+2H2O 或3Cu+8H++2NO3-$\frac{\underline{\;\;△\;\;}}{\;}$3Cu2++2NO↑+4H2O,Au、Pt和酸不反应,所以滤渣1的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+;第②步加H2O2的作用是将Fe2+氧化为Fe3+,过氧化氢做氧化剂不引入杂质,对环境无污染,调节溶液PH铁离子和铝离子全部沉淀后过滤得到氢氧化铁、氢氧化铝沉淀和滤液硫酸铜,所以滤渣2的主要成分是Fe(OH)3和Al(OH)3,滤液2冷却结晶得到五水合硫酸铜,将五水合硫酸铜在坩埚中加热脱水制得硫酸铜,在滤渣2中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体.
(1)H2O2的作用是将Fe2+氧化为Fe3+,Fe3+与OH-反应生成Fe(OH)3沉淀,据此书写离子反应方程式;
(2)由Al2(SO4)3溶液经过加热蒸发、冷却结晶、过滤、洗涤、干燥获得Al2(SO4)3•18H2O晶体;
(3)0.98 g Cu(OH)2受热分解得到的氧化物A、B应为CuO和Cu2O,结合生成A的质量为0.8 g,可知A是CuO,则B是Cu2O;结合图象可知高温时CuO分解为Cu2O,即高温时Cu2O较稳定,加热时CuO可将NH3氧化为N2,CuO被还原为单质Cu,现象是硬质玻璃管中黑色固体变成红色,烧杯中导管口部产生气泡,有无色、无味气体生成.
解答 解:稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe2+;所以滤渣1 的成分是Pt和Au,滤液1中的离子是Cu2+、Al3+、Fe2+,第②步加H2O2的作用是把Fe2+氧化为Fe3+,该氧化剂的优点是不引入杂质,产物对环境物污染,调溶液PH的目的是使Fe3+和Al3+形成沉淀.所以滤液2的成分是Cu2+,经蒸发结晶可得到CuSO4•5H2O晶体,滤渣2的成分为氢氧化铁和氢氧化铝,在滤渣中加NaOH,和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体.
(1)步骤②是在碱性条件下H2O2与Fe2+发生氧化还原反应生成Fe3+与OH-,Fe3+与OH-反应生成Fe(OH)3沉淀,反应为:2Fe2++H2O2+4OH-═2Fe(OH)3,
故答案为:2Fe2++H2O2+4OH-═2Fe(OH)3;
(2)由滤渣2制取Al2(SO4)3•18H2O,在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得硫酸铝晶体,所以最后的操作步骤为过滤、洗涤、干燥,
故答案为:过滤、洗涤、干燥;
(3)0.98gCu(OH)2固体物质的量为:0.01mol,依据分解图象分析判断,100°C时氢氧化铜分解产物为0.8g,高温1100°C得到B为0.72g,根据氢氧化铜分解生成氧化铜和水判断,Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O;氧化铜摩尔质量为80g/mol,所以推断A为CuO,B为Cu2O,依据温度图象可知Cu2O比CuO稳定,如CuO在加热条件下发生反应生成Cu和N2,则可观察到硬质玻璃管中黑色固体变成红色,烧杯中导管口部产生气泡,有无色、无味气体生成,
故答案为:CuO;较稳定;硬质玻璃管中黑色固体变成红色,烧杯中导管口部产生气泡,有无色、无味气体生成.
点评 本题考查制备硫酸铜和硫酸铝晶体的实验设计,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及实验的原理和方法,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2的燃烧热(△H)是285.8kJ•mol-1 | |
| B. | 反应2H2O(g)=2H2(g)+O2(g)H2的焓变(△H)是571.6kJ•mol-1 | |
| C. | 反应2H2O(l)=2H2(g)+O2(g)只能在电解条件下进行 | |
| D. | 反应2H2O(l)=2H2(g)+O2(g)在一定条件下可以自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1稀硫酸100mL中含有硫酸根个数为0.1NA | |
| B. | 1mol CH3+(碳正离子)中含有电子数为10NA | |
| C. | 2.4g金属镁与足量的盐酸反应,转移电子数为2NA | |
| D. | 12.4g白磷中含有磷原子数为O.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的HA溶液与pH=12的MOH溶液等体积混合后pH<7,则HA为弱酸 | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) | |
| C. | 物质的量浓度均为0.2mol•L-1CH3COOH和CH3COONa溶液等体积混合:2c(Na+)=c(CH3COO-)+c(CH3COOH)=0.2mol•L-1 | |
| D. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com