
【题目】有关元素X、Y、D、E的信息如下:
元素 | 有关信息 |
X | 地壳中含量最高的元素 |
Y | 第三周期中原子半径最小的元素 |
D | 最高价氧化物既能溶于强酸又能溶于强碱 |
E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
用化学用语回答下列问题:
(1)D在元素周期表中的位置为____。
(2)X、Y、D形成的简单离子的半径由大到小为_____。
(3)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为_________,D的单质溶于强碱的离子方程式为________。
(4)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号)_____。
①保存EY2溶液时,需向溶液加入少量E单质
②EY2、EY3均能通过化合反应生成
③向煮沸的NaOH溶液中滴加几滴饱和EY3溶液,可以制得胶体
【答案】第三周期第ⅢA族 r(Cl-)>r(O2-)>r(Al3+) 2H2O2![]() 2H2O+O2↑ 2Al+2OH-+2H2O=2A1O2-+3H2↑ ①②
2H2O+O2↑ 2Al+2OH-+2H2O=2A1O2-+3H2↑ ①②
【解析】
X是地壳中含量最高的元素,则其为氧(O);Y为第三周期中原子半径最小的元素,则其为氯(Cl);D元素的最高价氧化物既能溶于强酸又能溶于强碱,则其为铝(Al);E的单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏,则其为铁(Fe)。
(1)铝的原子结构示意图为 ,则其在元素周期表中的位置为第三周期第ⅢA族;
,则其在元素周期表中的位置为第三周期第ⅢA族;
(2)比较O2-、Al3+、Cl-的半径时,O2-、Al3+为两个电子层数,Cl-为三个电子层,则Cl-半径最大,O2-、Al3+的核电荷数,前者为8后者为13,所以离子半径前者大于后者,从而得出离子半径大小关系为r(Cl-)>r(O2-)>r(Al3+);
(3)X的一种氢化物可用于实验室制取X的单质,则其为H2O2,其反应的化学方程式为2H2O2![]() 2H2O+O2↑,Al的单质溶于强碱离子的离子方程式为2Al+2OH-+2H2O=2A1O2-+3H2↑;
2H2O+O2↑,Al的单质溶于强碱离子的离子方程式为2Al+2OH-+2H2O=2A1O2-+3H2↑;
(4)①保存FeCl2溶液时,需向溶液加入少量Fe单质,以防止Fe2+被空气中O2氧化,①正确;
②FeCl2可由Fe与FeCl3化合制得,FeCl3可由Fe与Cl2化合制得,②正确;
③向煮沸的NaOH溶液中滴加1~2mL饱和FeCl3溶液,并继续煮沸至液体呈红褐色,可以制得胶体,③错误;
故选①②。


科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,△H1>△H2的是 ( )
①C(s)+O2(g)=CO2(g) △H1 、C(s)+![]() O2(g)=CO(g) △H2
O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H1 、S(g)+O2(g)=SO2(g) △H2
③H2(g)+![]() O2(g)=H2O(l) △H1 、2H2(g)+O2(g)=2H2O(l) △H2
O2(g)=H2O(l) △H1 、2H2(g)+O2(g)=2H2O(l) △H2
④CaCO3(s)=CaO(s)+CO2(g) △H1 、CaO(s)+H2O(l)=Ca(OH)2(s) △H2
A. ①B. ④C. ②③④D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
A.电池的电解质溶液为碱性溶液,阳离子向正极移动
B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸(H3BO3)及轻质氧化镁的工艺流程如下:
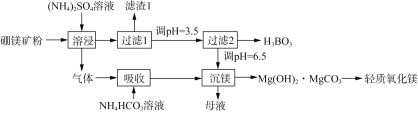
回答下列问题:
(1)“溶浸”硼镁矿粉过程中,提高B、Mg元素的浸出率可以采用什么措施________(填写两点)。
(2)“溶浸”后产生的气体是__________(填化学式)。
(3)为检验“过滤1”后的滤液中是否含有Fe3+,可选用的化学试剂是______________溶液(填化学式)。
(4)根据H3BO3的解离反应:H3BO3+H2O![]() H++B(OH)4,Ka=5.81×10-10,写出H3BO3与NaOH反应的离子方程式________________________________________。
H++B(OH)4,Ka=5.81×10-10,写出H3BO3与NaOH反应的离子方程式________________________________________。
(5)写出“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式以及将碱式碳酸镁高温灼烧制备轻质氧化镁的化学方程式________________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是科学探究过程中的一种重要方法,掌握化学实验的基本操作和物质的制备、转化及性质的探究尤为重要,请结合所学化学实验知识回答以下问题。某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
探究:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:

(1)装置A中盛放的试剂是____(填选项),化学反应方程式是___。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
①HCl的溶解度比H2S大 ②HCl的酸性比H2S强 ③HCl的稳定性比H2S大④HCl的还原性比H2S弱⑤HClO4的酸性比H2SO4强 ⑥还原性:Cl-<S2- ⑦Cl2能与H2S反应生成S ⑧在周期表中Cl处于S同周期的右侧
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液_______的现象,即可证明。用元素周期律理论解释非金属性Cl>I的原因:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌的配合物[Zn(NH3)4]2+、ZSM、[Zn(N2H4)2(N3)2] n等用途非常广泛。
(1)Zn2+基态核外电子排布式为________________________。
(2)Zn2+能与NH3形成配离子[Zn(NH3)4]2+。配体NH3分子属于________(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键___________。

(3)ZSM是2-甲基咪唑和水杨酸与锌形成的配合物,2-甲基咪唑可通过下列反应制备:

①与CN-互为等电子体的分子是____________(填化学式,写两种)。
②2-甲基咪唑中碳原子杂化轨道类型为________;1 mol 2-甲基咪唑分子中含σ键和π键之比为________。
③乙二胺易溶于水的主要原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.5mol/L NaOH溶液和0.5mol/L硫酸溶液进行中和热的测定。
Ⅰ.准备仪器
(1)环形玻璃搅拌棒__________(填“能”或“不能”)改为环形金属(如铜)棒,其原因是__________。
(2)碎泡沫的作用是______________,终止温度应为反应的最________(填“高”或“终”)温度。
II.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。

(1)四次实验所得到的温度平均值为__________℃。
(2)取50mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如表。
①近似认为0.5mol/LNaOH溶液和0.5mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J·g-1·℃-1。则中和热△H =_____(取小数点后一位)。
②上述实验数值结果与573KJ·mol-1有偏差,产生偏差的原因可能是(填字母)_____。
a.实验装置保温、隔热效果差
b. 量取NaOH溶液的体积时仰视读数
c. 分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.反应时未用搅拌器搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可利用反应2Cr2O72-+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH检测乙醇。下列说法错误的是( )
A.基态Cr3+的核外电子排布式为3d3
B.[Cr(H2O)6]3+中与Cr3+形成配位键的原子是氧原子
C.CH3COOH分子中含有7个![]() 键
键
D.已知CrO42-是以Cr为中心的四面体结构,则Cr2O72-结构中含有两个四面体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成:

下列说法不正确的是
A.等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为3:2
B.X的分子式为C11H14O5
C.由X制取Y的过程中可得到甲醇
D.一定条件下,Y能发生氧化反应和加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com