
【题目】硫酸在生活和生产中应用广泛。某工厂以黄铁矿(主要成分为FeS2)为原料,采用接触法制备硫酸。
(1)已知在298 K和101 kPa条件下:
FeS2(s)=FeS(s)+S(s) H1
S(s)+ O2(g)=SO2(g) H2
4FeS(s)+7O2(g)=2Fe2O3(s) +4SO2(g) H3
则在该条件下FeS2与O2生成Fe2O3和SO2的热化学方程式为_______。
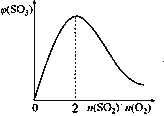
(2)催化氧化反应:2SO2(g) +O2(g)![]() 2SO3(g) H<0。在体积可变的密闭容器中,维持压强为101 kPa和初始n(SO2)=2mol,充入一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图所示:
2SO3(g) H<0。在体积可变的密闭容器中,维持压强为101 kPa和初始n(SO2)=2mol,充入一定量的O2,SO2的平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图所示:
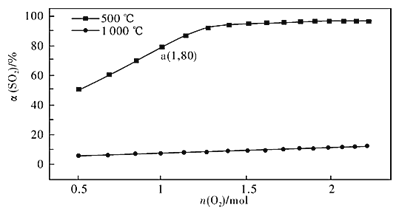
①在1000℃时,SO2平衡转化率随着O2物质的量的增大缓慢升高,解释其原因________。
②a点时SO3的平衡分压p(SO3)=_________Pa(保留两位有效数字,某组分的平衡分压=总压×某组分的物质的量分数)。
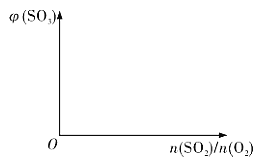
(3)保持温度不变,向固定体积的密闭容器中充入一定量的SO2、O2。请画出平衡体系中SO3的体积分数φ(SO3)随初始SO2、O2的物质的量之比[n(SO2)/n(O2)]的变化趋势图______:
(4)已知活性氧可以把SO2快速氧化为SO3,根据计算机模拟结果,在炭黑表面上O2转化为活性氧的反应历程与能量变化关系如图所示。下列说法不正确的是_______(填字母代号)。
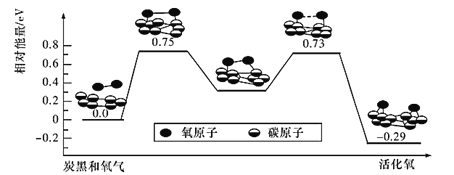
A.O2转化为活性氧是氧氧键的断裂与碳氧键的生成过程
B.该过程的最大能垒(活化能)E正=0.73 eV
C.每活化一个O2分子最终吸收0. 29 eV能量
D.依题炭黑可以作为SO2转化为SO3的催化剂
E.其他条件相同时,炭黑颗粒越小,反应速率越快
(5)硫酸工厂尾气中的SO2可被NaOH溶液吸收,用惰性电极将所得的Na2SO3溶液进行电解,可循环再生NaOH的同时得到H2SO4,写出阳极的电极反应式:___________
【答案】4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) H=2H1+2H2+H3 该反应H<0,1000![]() 时,该反应的平衡常数很小,二氧化硫的平衡转化率很小;1000
时,该反应的平衡常数很小,二氧化硫的平衡转化率很小;1000![]() 时,恒压条件下,充入氧气,c(SO2)和c(SO3)等倍数减,c(O2)增大,Qc=
时,恒压条件下,充入氧气,c(SO2)和c(SO3)等倍数减,c(O2)增大,Qc=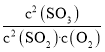 <K,平衡正向移动,二氧化硫的平衡转化率增大;
<K,平衡正向移动,二氧化硫的平衡转化率增大; ![]()
 BC SO32-+H2O-2e-=SO42-+2H+
BC SO32-+H2O-2e-=SO42-+2H+
【解析】
(1)①FeS2(s)=FeS(s)+S(s) H1;②S(s)+ O2(g)=SO2(g) H2;
③4FeS(s)+7O2(g)=2Fe2O3(s) +4SO2(g) H3;根据盖斯定律,①×2+②×2+③得热化学反应方程式为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) H=2H1+2H2+H3;故答案为:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) H=2H1+2H2+H3;
(2)①该反应H<0,1000![]() 时,根据二氧化硫的转化曲线,该反应的平衡常数很小,二氧化硫的平衡转化率很小;1000
时,根据二氧化硫的转化曲线,该反应的平衡常数很小,二氧化硫的平衡转化率很小;1000![]() 时,恒压条件下,充入氧气,c(SO2)和c(SO3)等倍数减,c(O2)增大,Qc=
时,恒压条件下,充入氧气,c(SO2)和c(SO3)等倍数减,c(O2)增大,Qc=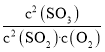 <K,平衡正向移动,二氧化硫的平衡转化率增大;故答案为:该反应H<0,1000
<K,平衡正向移动,二氧化硫的平衡转化率增大;故答案为:该反应H<0,1000![]() 时,该反应的平衡常数很小,二氧化硫的平衡转化率很小;1000
时,该反应的平衡常数很小,二氧化硫的平衡转化率很小;1000![]() 时,恒压条件下,充入氧气,c(SO2)和c(SO3)等倍数减,c(O2)增大,Qc=
时,恒压条件下,充入氧气,c(SO2)和c(SO3)等倍数减,c(O2)增大,Qc=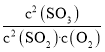 <K,平衡正向移动,二氧化硫的平衡转化率增大;
<K,平衡正向移动,二氧化硫的平衡转化率增大;
②

SO3的平衡分压p(SO3)=![]() ,故答案为:
,故答案为:![]() ;
;
(3)保持温度不变,向固定体积的密闭容器中充入一定量的SO2、O2,二氧化硫与氧气比例为2:1时,三氧化硫的平衡体积分数最大,故答案为: ;
;
(4)A. 由图分析可知,O2转化为活性氧是氧氧键的断裂与碳氧键的生成过程,A正确;
B. 该过程的最大能垒(活化能)E正=0.75eV,B错误;
C. 每活化一个O2释放0. 29 eV能量,C错误;
<>D. 炭黑可以提供活化氧,可作为SO2转化为SO3的催化剂,D正确;E. 其他条件相同时,炭黑颗粒越小,反应接触面积越大,反应速率越快,E正确;故答案为:BC;
(5)用惰性电极将所得的Na2SO3溶液进行电解,可循环再生NaOH的同时得到H2SO4,阳极是亚硫酸根离子失去电子,生成硫酸根离子,即阳极的电极反应为:SO32-+H2O-2e-=SO42-+2H+;故答案为:SO32-+H2O-2e-=SO42-+2H+。


科目:高中化学 来源: 题型:
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
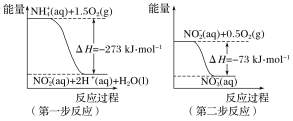
①第一步反应是________(填“放热”或“吸热”)反应,判断依据是________________。
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是___________________________。
(2)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+0.5O2(g) ΔH=-226kJ·mol-1②
则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为________________。
(3)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图中各装置的叙述正确的是( )

A.装置①可制备少量氧气
B.装置②可用于实验室制取和收集乙酸乙酯
C.装置③的实验可推断硫、碳、硅三种元素的非金属强弱
D.装置④能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镉镍可充电电池的充、放电反应按下式进行:Cd+2NiO(OH)+2H2O![]() Cd(OH)2+2Ni(OH)2,由此判断,下列说法错误的是
Cd(OH)2+2Ni(OH)2,由此判断,下列说法错误的是
A. 放电时,NiO(OH)作正极
B. 放电时,Cd发生还原反应
C. 电解质溶液为碱性溶液
D. 充电时,阳极反应为Ni(OH)2+OH--e-== NiO(OH)+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半,下列说法正确的是( )
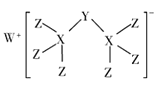
A.氧化物对应的水化物的酸性:Z> Y> X
B.元素X可与元素W形成化合物W2X,该化合物与水能产生可燃气体
C.该新化合物中Y不满足8电子稳定结构
D.Z氢化物的沸点一定比X氢化物的佛点高.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.50mol·L-1盐酸与50mL0.55 mol·L -1NaOH 溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是

A. 在测定中和热的实验中,至少需要测定并记录的温度是3次
B. 大烧杯上如不盖硬纸板,测得的中和热数值会偏小
C. 用相同浓度和体积的氨水代替NaOH 溶液进行上述实验,测得中和热的数值会偏大
D. 从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:
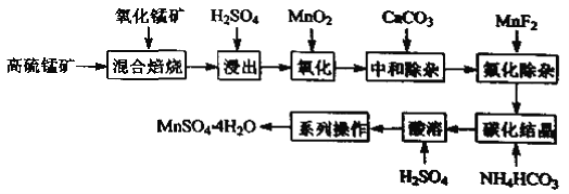
已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):
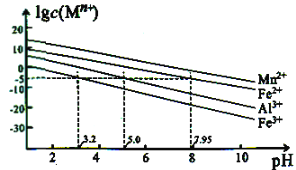
③此实验条件下Mn2+开始沉淀的pH为7.54;当离子浓度≤105mol·L1时,可认为离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为____。
(2)“氧化”时,发生反应的离子方程式为____。若省略“氧化”步骤,造成的后果是____。
(3)“中和除杂”时,生成沉淀的主要成分为____(填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于____。(已知:Ksp(MgF2)=6.4×1010;Ksp(CaF2)=3.6×1012)
(5)“碳化结晶”时,发生反应的离子方程式为_____。
(6)用惰性电极电解MnSO4溶液可制备MnO2,电解过程中阳极的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴是一种中等活泼金属,化合价为+2价和+3价,其中CoC12易溶于水。某校同学设计实验制取(CH3COO)2Co(乙酸钴)并验证其分解产物。回答下列问题:
(1)甲同学用Co2O3与盐酸反应制备CoC124H2O,其实验装置如下:
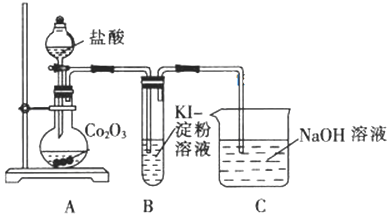
①烧瓶中发生反应的离子方程式为______。
②由烧瓶中的溶液制取干燥的CoC124H2O,还需经过的操作有蒸发浓缩、______、洗涤、干燥等。
(2)乙同学利用甲同学制得的CoC124H2O在醋酸氛围中制得无水(CH3COO)2Co,并利用下列装置检验(CH3COO)2Co在氮气气氛中的分解产物。已知PdC12溶液能被CO还原为Pd。
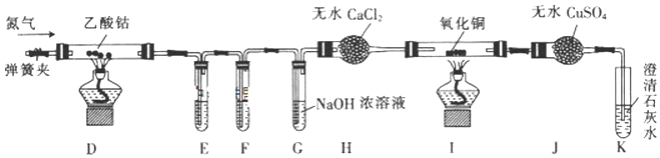
①装置E、F是用于检验CO和CO2的,其中盛放PdC12溶液的是装置______(填“E”或“F”)。
②装置G的作用是______;E、F、G中的试剂均足量,观察到I中氧化铜变红,J中固体由白色变蓝色,K中石灰水变浑浊,则可得出的结论是______。
③通氮气的作用是______。
④实验结束时,先熄灭D和I处的酒精灯,一段时间后再关闭弹簧夹,其目的是______。
⑤若乙酸钴最终分解生成固态氧化物X、CO、CO2、C2H6,且n(X):n(CO):n(CO2):n(C2H6)=1:4:2:3(空气中的成分不参与反应),则乙酸钴在空气气氛中分解的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。已知:铟与铝(13Al)同主族。下列说法错误的是( )
A.In的金属性大于Al
B.In最外层有2种能量的电子
C.![]() In的中子数为66
In的中子数为66
D.![]() In原子的相对原子质量为115
In原子的相对原子质量为115
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com