
| A. | 向澄清石灰水中通入足量二氧化碳:OH-+CO2═HCO3- | |
| B. | 氧化钠投入水中发生反应:O2-+H2O═2OH- | |
| C. | 硝酸银溶液中加入铜粉:Ag++Cu═Cu2++Ag | |
| D. | 金属铁溶于稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
科目:高中化学 来源: 题型:选择题
| A. | ag C2H4和C3H6的混合物所含原子总数为$\frac{a{N}_{A}}{14}$ | |
| B. | 0.5mol/L MgCl2溶液,含有Cl-离子数为NA | |
| C. | 10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% | |
| D. | 300 mL 2 mol/L蔗糖溶液中所含分子数大于0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
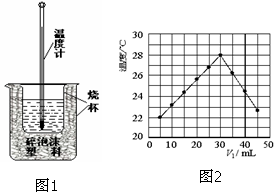 用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用稀盐酸与稀NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸试剂的物质的量浓度为18.4 | |
| B. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% | |
| C. | 配制50.0mL4.6mol•L-1的稀硫酸需取该硫酸12.5mL | |
| D. | 2.4gMg与足量的该硫酸反应得到H2 的体积为2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| H2(g) | N2(g) | NH3(g) | |
| 1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
| A. | 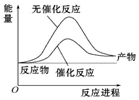 如图可表示合成氨过程中的能量变化 | |
| B. | a的数值为391 | |
| C. | Q1的数值为92 | |
| D. | 相同条件下,反应物若为2 mol N2和6 mol H2,放出热量Q2>2Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
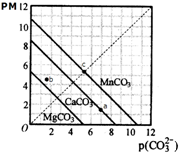
| A. | a点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) | |
| B. | b点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32-) | |
| C. | c可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO32-) | |
| D. | MgCO3、CaCO3、MnCO3的Ksp依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com