
分析 (1)①H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286KJ/mol,
②$\frac{2}{3}$NH3(g)+$\frac{1}{2}$O2(g)═$\frac{1}{3}$N2(g)+H2O(l)△H=-382.5KJ/mol,①×3-②×2得,N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1;
(2)w(N2)=$\frac{1}{1+1}×100%$=50%,再根据三段式求出反应后氮气的体积分数,前后进行比较;
(3)据v=$\frac{△c}{△t}$;K=$\frac{1}{{c}^{2}(N{H}_{3})c(C{O}_{2})}$据此进行计算;
②若保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入0.6mol NH3,体积瞬间变为4L,此时c(NH3)=0.25mol•L-1,c(CO2)=0.05mol•L-1,反应的浓度商Q=$\frac{1}{0.2{5}^{2}×0.05}$=320,Q>K,所以平衡逆向移动;
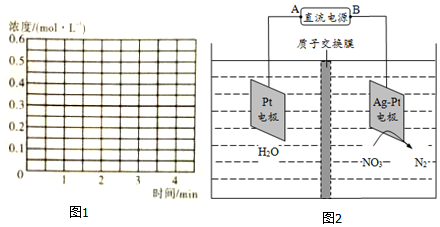
③2min时把容器体积瞬间压缩到1L,此时c(NH3)=0.4mol•L-1,保持T℃不变,平衡常数K不变,则3min平衡时NH3浓度仍为 0.2mol•L-1,据此进行作图;
(4)①由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;在阴极反应是NO3-得电子发生还原反应生成N2,据此进行分析;
②转移1mol电子时,阳极产生O28 g,并产生1g H+进入阴极室,阳极室质量减少9 g,阴极室中放出0.1 mol N2,质量减少2.8g,同时有1mol H+进入阴极室,阴极室质量共减少1.8g,若电解过程中转移了1mol电子,则膜两侧电解液的质量变化差值(△m左-△m右)为9g-1.8g=7.2 g.
解答 解:(1)①H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286KJ/mol,
②$\frac{2}{3}$NH3(g)+$\frac{1}{2}$O2(g)═$\frac{1}{3}$N2(g)+H2O(l)△H=-382.5KJ/mol,①×3-②×2得,N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ•mol-1;
(2)开始w(N2)=$\frac{1}{1+1}×100%$=50%,设开始氮气,氢气的物质的量分别为1mil,1mol,
N2(g)+3H2(g)?2NH3(g)
初始量 1 1 0
转化量 X 3X 2X
平衡量 1-X 1-3X 2X,
反应后氮气的体积分数为$\frac{1-X}{1-X+1-3X+2X}×100%$=$\frac{1-X}{2-2X}$×100%=50%,则N2的体积分数恒为50%,由此可见,平衡时N2的体积分数保持不变,
故答案为:C;
(3)①2NH3(g)+CO2(g)═CO (NH2)2(s)+H2O(l);
初始量(c) 0.6 0.3 0 0
转化量 0.4 0.2
平衡量 0.2 0.1
v(NH3)=$\frac{0.4mol/L}{2min}$=0.2mol•L-1•min-1;
K=$\frac{1}{{c}^{2}(N{H}_{3})c(C{O}_{2})}$=$\frac{1}{0.{2}^{2}×0.1}$=250;
故答案为:0.2mol•L-1•min-1;250;
②若保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入0.6mol NH3,体积瞬间变为4L,此时c(NH3)=0.25mol•L-1,c(CO2)=0.05mol•L-1,反应的浓度商Q=$\frac{1}{0.2{5}^{2}×0.05}$=320,Q>K,所以平衡逆向移动,v正<v逆,
故答案为:<;
③2min时把容器体积瞬间压缩到1L,此时c(NH3)=0.4mol•L-1,保持T℃不变,平衡常数K不变,则3min平衡时NH3浓度仍为 0.2mol•L-1,故图象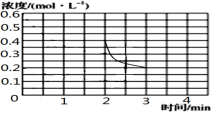 ,
,
故答案为: ;
;
(4)①由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知阴极上发生的电极反应式为:2NO3-+12H++10e-═N2↑+6H2O,
故答案为:A;2NO3-+12H++10e-═N2↑+6H2O;
②转移1mol电子时,阳极产生O28 g,并产生1g H+进入阴极室,阳极室质量减少9 g,阴极室中放出0.1 mol N2,质量减少2.8g,同时有1mol H+进入阴极室,阴极室质量共减少1.8g,若电解过程中转移了1mol电子,则膜两侧电解液的质量变化差值(△m左-△m右)为9g-1.8g=7.2 g,
故答案为:7.2.
点评 本题考查热化学方程式的书写,化学反应速率及平衡常数的计算,电极反应方程式的书写等,本题难度中等.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A. | 该反应的正反应是吸热反应 | |
| B. | 该反应达到平衡后,保持容器体积不变升高温度,正反应速率不变,容器内混合气体的压强不变 | |
| C. | 830℃时,在恒容反应器中按物质的量比n(CO):n(H2O):n(H2):n(CO2)=2:4:6:1投入反应混合物发生上述反应,初始时刻υ正<υ逆 | |
| D. | 830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是60% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铵盐都易溶于水 | |
| B. | 铵盐受热分解都能得到氨气 | |
| C. | 除去NH4Cl溶液中少量的CaCl2,加过量的NH4HCO3溶液后过滤 | |
| D. | 铵盐与碱液共热都能生成使蓝色石蕊试变红的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强氧化剂制弱氧化剂 | B. | 强酸制弱酸 | ||
| C. | “熵增效应(熵判据)” | D. | 产物中形成了配位键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com