
| A、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | ||
| B、所有的化学反应都需要一定的活化能来推动 | ||
C、CH3COOH 溶液加水稀释后,溶液中
| ||
| D、Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小 |
| c(CH3COOH) |
| c(CH3COO-) |


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
| A、HCOOH+H2O?HCOO-+H3O+ |
| B、CO2+H2O?H2CO3 |
| C、CO32-+H2O?HCO3-+OH- |
| D、HCO3-+H2O?CO32-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应前物质质量/g | 反应后物质质量/g | |
| Cu-Zn合金 | 稀硫酸 | 滤液质量 |
| 4.0 | 10 | 11.26 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ag+、Ba2+、Cl- |
| B、Na+、HCO3-、OH- |
| C、NH4+、SO42-、NO3- |
| D、K+、OH-、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
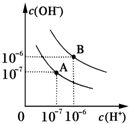 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
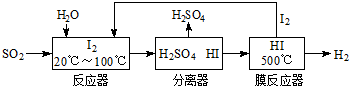
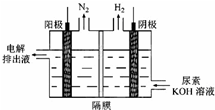
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol/L的CH3COOH |
| B、0.01mol/LNaHSO4 |
| C、0.01mol/LNaHCO3 |
| D、0.005mol/LH2SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com