
【题目】综合题。
(1)在一定条件下,21.6gA单质与1.20molCl2完全反应,生成0.800molAClx,则x= , A的摩尔质量为 .
(2)实验室需要2.0molL﹣1NaOH溶液90mL,用托盘天平称取氢氧化钠,其质量为g;
(3)将5.60g铁投入100mL某浓度的盐酸中,铁和盐酸恰好完全反应.求:
①所用盐酸中HCl的物质的量浓度为
②反应中生成的H2在标准状况下的体积为
【答案】
(1)3;27g/mol
(2)8.0
(3)2.0mol/L;2.24L
【解析】解:(1)根据质量守恒,0.800molAClx中含有0.800molA和0.800xmolCl,所以1.20molCl2中含有2.4molCl,即0.800xmol=2.4,解得:x=3,
21.6gA的物质的量为0.800mol,A的摩尔质量为: ![]() =27g/mol,
=27g/mol,
所以答案是;3;27g/mol.(2)实验室需要2.0molL﹣1NaOH溶液90mL,实际上配制的是100mL 2.0mol/LNaOH溶液,需要氢氧化钠的物质的量为:2.0mol/L×0.1L=0.2mol,需要氢氧化钠的质量为:40g/mol×0.2mol=8.0g,
所以答案是:8.0;(3)①n(Fe)= ![]() =0.1mol,设盐酸的物质的量为xmol,由反应Fe+2HCl=FeCl2+H2↑可知,
=0.1mol,设盐酸的物质的量为xmol,由反应Fe+2HCl=FeCl2+H2↑可知,
Fe+ | 2HCl= | FeCl2+ | H2↑ |
1 | 2 | ||
0.1mol | xmol |
则 ![]() =
= ![]() ,解得:x=0.2,
,解得:x=0.2,
则该盐酸的浓度为:c(HCl)= ![]() =2.0mol/L,
=2.0mol/L,
答:所用盐酸中HCl的物质的量浓度为2.0mol/L;②设生成氢气的物质的量为ymol,根据反应可知:
Fe+ | 2HCl= | FeCl2 + | H2↑ |
1 | 1 | ||
0.1mol | ymol |
则有: ![]() =
= ![]() ,解得:y=0.1,
,解得:y=0.1,
即n(H2)=0.1mol,标况下体积生成氢气的体积为:V=0.1mol×22.4L/mol=2.24L,
答:生成的H2在标准状况下的体积为2.24L.


科目:高中化学 来源: 题型:
【题目】25℃时,向100mL 0.1molL﹣1 NH4HSO4溶液中滴加0.1molL﹣1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸).下列说法错误的是( ) 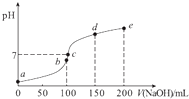
A.a点时溶液的pH<1
B.c点时离子浓度大小顺序为:c(Na+)>c(SO42﹣)>c(NH4+)
C.de段上的点均满足关系式:c(NH4+)+c(Na+)>2c(SO42﹣)
D.a点到b点的过程中,溶液的导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示,由此可判断( ) 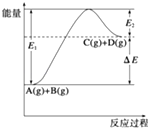
A.1mol A与1mol B充分反应后,能量变化为△E
B.加入催化剂后,反应加快,△E减小
C.反应物的总键能小于生成物的总键能
D.反应达到平衡时,升高温度,A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mLNaBr和NaI的混合溶液中缓慢通入适量的Cl2,充分反应后将所得溶液蒸干,并将所得固体灼烧至恒重,得到mg固体。m与通入Cl2的体积[V(Cl2),标准状况]关系如图所示。则下列说法不正确的是
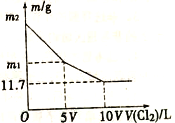
A. V=0.224 B. 混合溶液中:c(Na+)=2 mol/L
C. m2=25.3 D. m1=18.55
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)△H=a kJ/mol 在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
A.10 min内,T1时CH4的化学反应速率比T2时小
B.温度:T1<T2
C.a<0
D.平衡常数:K(T1)<K(T2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】框图中甲、乙为单质,其余均为化合物,B为常见液态化合物,A为淡黄色固体,F、G所含元素相同且均为氯化物。G遇KSCN溶液显红色。
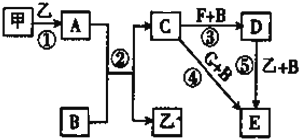
请回答下列问题:
(1)上述5个反应中,既属于氧化还原反应又属于化合反应的是_________________(填序号)。
(2)反应⑤的化学方程式为________________________________。
(3)甲与B反应的离子方程式为________________________________。
(4)在实验室将C溶液滴入F溶液中,观察到的现象是________________________________。
(5)在F溶液中加入等物质的量的A,发生反应的总的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的熔沸点高低比较正确的是( )
A.邻二甲苯( ![]() )、邻羟基苯甲醛(
)、邻羟基苯甲醛( ![]() )熔沸点均于其对应对位取代物
)熔沸点均于其对应对位取代物
B.卤素元素的单质及其氢化物的熔沸点随原子半径的增大而升高
C.石墨、金刚石、碳化硅、晶体硅、白磷、水、干冰熔沸点依次降低
D.NaCl、MgCl2、MgO,Al2O3熔沸点依次减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,隔板K可左右移动,甲中充入2mol A和1mol B,乙中充入2mol C和1mol He,此时K停在0处.发生反应2A(g)+B(g)2C(g),达到平衡后,恢复至温度.下列有关说法不正确的是
( )
A.达平衡后,隔板K最终停留在左侧刻度0~2之间
B.若平衡时K停留在左侧1处,则活塞停留在右侧6处
C.达到平衡时,甲容器中B的物质的量小于于乙容器中B的物质的量
D.根据隔板K滑动与否可判断左右两边的反应是否达到平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com