
科目:高中化学 来源: 题型:

| 1 |
| 2 |
| 催化剂 |
| △ |
| T/K | 673 | 723 | 823 | 923 |
| K | 423 | 37.4 | 20.5 | 4.68 |
| CO |
| 高温 |
| 稀硫酸 |
| 稀硫酸 |
| 铁屑 |
| 铁粉 |
| 高温 |
| 稀硫酸 |
| H2 |
| 高温 |
| 硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| ||
| △ |
| T/K | 673 | 723 | 823 | 923 |
| K | 423 | 37.4 | 20.5 | 4.68 |
| ||
| 高温 |
| 浓硫酸 |
| 浓硫酸 |
| 铁屑 |
| 铁粉 |
| 高温 |
| 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
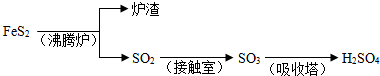
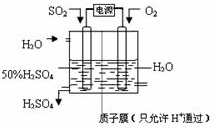
硫酸工业生产应考虑综合经济效益问题。
⑴若1g含SiO2和FeS2的某硫铁矿样品,在氧气中充分燃烧,残余固体质量为0.84g。某硫酸厂每天用这种矿石500t生产硫酸,如果在沸腾炉内损失5%的硫,SO2的转化率为90%,则每天可以制得98%的H2SO4质量为 t。
⑵某硫酸厂以硫为原料每天生产98%的H2SO4 a t。若送风(鼓入空气)后使硫充分燃烧,并在下一步催化氧化时不再补充空气,设送风机每天输送空气的体积为b m3/台(标准状况)。求理论上至少应安装 台送风机(空气中氧气的体积分数为21%)。
⑶硫酸工业的尾气通常是转化为硫酸铵的。若尾气中SO2、O2的体积分数分别为0.4%和0.5%。向尾气中通入空气(设空气中O2的体积分数为20.5%,且不含SO2),在400℃、催化剂作用下反应,再与NH3混合,同时喷水降温至200℃,在热的结晶装置中得到(NH4)2SO4晶体。若某硫酸厂每天排放出的尾气为5×105m3(标准状况),按上述方法该厂每月(以30天计)最多能获得 吨硫酸铵?
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市八校高三年级联合调研考试化学试卷(解析版) 题型:计算题
黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取2.000g样品在空气中充分灼烧(假设杂质不参加反应),将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.3360mol·L-1的KMnO4标准溶液滴定至终点,消耗KMnO4溶液25.00mL。
已知:①4FeS2+11O2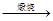 2Fe2O3+8SO2
2Fe2O3+8SO2
②SO2+2Fe3++2H2O→SO42-+2Fe2++4H+
③MnO4-+5Fe2++8H+→Mn2++5Fe3++4H2O
(1)样品中FeS2的质量分数是 。(用小数表示,保留三位,下同)
(2)煅烧1000 t该黄铁矿生产出997.9 t硫酸铵,若黄铁矿制取硫酸时的利用率为0.800,则在制取硫酸铵时硫酸的利用率为 。
(3)为使黄铁矿充分燃烧,工业上使用过量空气(设空气中O2的体积分数为0.200),当空气过量20%时,煅烧后气体中SO2的体积分数是多少?
(4)若接触室导出的气体中含体积分数为0.0672的SO3。把出口气体送进吸收塔,用质量分数为0.980的硫酸吸收,可得到“发烟H2SO4”(H2SO4和SO3的混合物,其中含质量分数为0.200的SO3)。计算吸收106 m3出口气体(已折算为标准状况)所需要质量分数为0.980的硫酸的质量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com