
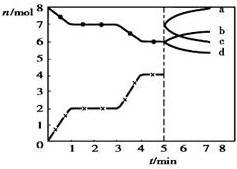
| A. | 1~3min时,v(CO)=v(CO2) | |
| B. | 当容器内的压强不变时,该反应一定达到平衡状态,且$\frac{P(平衡)}{P(开始)}<1$ | |
| C. | 若3min时温度由T1升高到T2,则Q>O,且$\frac{K({T}_{2})}{K({T}_{1})}$=4.7 | |
| D. | 5min时再充入一定量的CO,c、b曲线分别表示n(CO)、n(CO2)的变化 |
分析 A、依据图象分析单位时间内一氧化碳和二氧化碳物质的量浓度的变化,结合化学反应速率概念分析计算,1-3min反应达到平衡判断;
B、反应是气体体积增大的反应,压强不变,说明反应达到平衡,反应气体物质的量之比等于压强之比;
C、依据图象3min升高温度,一氧化碳增多,说明反应是吸热反应,分析图象平衡物质的量,计算平衡状态下平衡常数;
D、改变一氧化碳的量,增加一氧化碳,瞬间一氧化碳物质的量增大,然后反应平衡逆向进行,一氧化碳减小,二氧化碳增大.
解答 解:A、依据图象分析单位时间段内一氧化碳和二氧化碳物质的量的变化,0~1min,一氧化碳物质的量增加2mol,反应速率υ(CO)=$\frac{\frac{2mol}{2L}}{1min}$=1 mol/(L•min);1~3min时,平衡不动,反应速率等于化学计量数之比,υ(CO)=2υ(CO2),故A错误;
B、反应是气体体积增大的反应,压强不变,说明反应达到平衡,反应气体物质的量之比等于压强之比,P(平衡)>P(起始),$\frac{P(平衡)}{P(开始)}$>1,故B错误;
C、依据图象3min升高温度,一氧化碳增多,说明反应是吸热反应,T1温度平衡,一氧化碳物质的量为2mol,二氧化碳物质的量为7mol;平衡常数K1=$\frac{{c}^{2}(CO)}{c(C{O}_{2})}$=$\frac{(\frac{2mol}{2L})^{2}}{\frac{7mol}{2L}}$=$\frac{2}{7}$;T2温度平衡,一氧化碳物质的量为4mol,二氧化碳物质的量为6mol,平衡常数K2=$\frac{{c}^{2}(CO)}{c(C{O}_{2})}$=$\frac{(\frac{4mol}{2L})^{2}}{\frac{6mol}{2L}}$=$\frac{4}{3}$,则 $\frac{K({T}_{2})}{K({T}_{1})}$=$\frac{14}{3}$=4.7,故C正确;
D、改变一氧化碳的量,增加一氧化碳,瞬间一氧化碳物质的量增大,然后反应平衡逆向进行,一氧化碳减小,二氧化碳增大,c、b曲线分别表示n(CO)、n(CO2)的变化,故D正确;
故选CD.
点评 本题考查图象分析判断,反应速率计算应用,平衡常数计算判断,平衡影响因素的分析判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②⑦⑧ | B. | ①②③⑥ | C. | ①②⑥⑦ | D. | ①②⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3N4晶体是分子晶体 | |
| B. | C3N4晶体中,C原子采用sp3杂化,氮原子采用sp2杂化 | |
| C. | C3N4晶体中,C-N键的键长比金刚石中的C-C键的键长要短 | |
| D. | C3N4晶体中存在配位键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下能溶于水 | B. | 水溶液能导电 | C. | 具有较高的熔点 | D. | 熔融状态能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com